题目内容
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
| A.该溶液的pH=4 |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
B
试题分析: HA
 H+ + A-
H+ + A-C0 0.1 0 0
△C 0.1×0.1% 1×10-4 1×10-4
C(平衡) 0.1×(1-0.1%) 1×10-4 1×10-4
升高温度,平衡正向移动,C(H+)增大,PH值减小,故B错误;C(H+)=1×10-4,则PH=4,故A正确;K=[(1×10-4)× (1×10-4)]/[ 0.1×(1-0.1%)]= 1×10-7,故C正确;利用Kw= C(H+)C(OH-),得:C水(OH-)=1×10-10= C水(H+),所以:HA电离出的c(H+)=1×10-4, C水(H+)=1×10-10,故D正确。
点评:本题主要根据电离程度计算出电离平衡常数。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
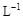 醋酸溶液加水稀释,下列说法正确的是()
醋酸溶液加水稀释,下列说法正确的是() NH+OH-,下列情况能引起电离平衡向正向移动的有 ( )
NH+OH-,下列情况能引起电离平衡向正向移动的有 ( )
 2H++SO32-
2H++SO32-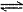 H3O++CO32-
H3O++CO32-