题目内容
【题目】用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A. 放电时,甲电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
B. 放电时,甲电极为正极,OH-移向乙电极
C. 电池放电时总反应为H2+2NiO(OH)=2Ni(OH)2
D. 充电时,电池的碳电极与直流电源的正极相连
【答案】C
【解析】
放电时,该电池为原电池,甲电极为负极,H2在电极上放电,乙电极为正极,NiO(OH)在电极上放电;充电时,应将甲电极与外电源的负极相连作阴极,乙电极与外电源的正极相连作阳极。
A项、放电时,甲电极为负极,H2在电极上放电,电极反应式为H2-2e-+2OH-=2H2O,故A错误;
B项、放电时,甲电极为负极,电解质溶液中阴离子向负极移动,所以OH-向负极甲电极移动,故B错误;
C项、放电时,正极电极反应式为2NiO(OH)+2H2O+2e-═2Ni(OH)2+2OH-,负极电极反应式为:H2+2OH--2e-═2H2O,放电时总反应为H2+2NiO(OH)=2Ni(OH)2,故C正确;
D项、放电时,氢气在碳电极发生氧化反应,碳电极作负极,充电时,碳电极发生还原反应作阴极,应与电源的负极相连,故D错误。
故选C。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:配制待测白醋溶液,用酸式滴定管量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀即得待测白醋溶液。量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
(1)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
![]()
(2)滴定。判断滴定终点的现象是________________________________,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数。重复滴定3次。
Ⅱ.实验记录:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(3)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4=15.24 mL。指出他的计算的不合理之处:_________________。
(4)按正确数据处理,得出c(市售白醋)=_______mol·L-1,市售白醋总酸量=____g·100mL-1。
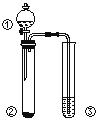
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
A. A B. B C. C D. D