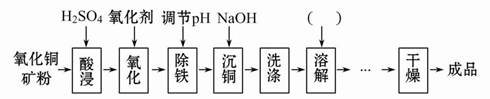
题目内容
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,MnO4 - 可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2S04溶解A1203的离子方程式是
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:( Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的: ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式: ;
③Ⅲ中加入MnS04的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 。(填化学式)
(1)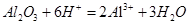 (2分)
(2分)
(2)取少量滤液,滴加KMnO4溶液(2分),KMnO4溶液褪色(1分)
(3)①将Fe2+氧化为Fe3+,(2分)调节pH值使铁完全沉淀;(2分)
②生成有黄绿色气体(2分);MnO2+4HCl= MnCl2+ Cl2↑+2H2O(2分)
③除去过量的MnO4-。(1分)
(4)K2SO4。(2分)
解析试题分析: (1)硫酸溶解氧化铝的离子方程是属于基础题,该离子方程式为A1203+6H+= 2A13++ 3H20。
(2)由于在上述流程中,所得的滤液既含有亚铁离子,又含有铁离子,因此二者共存时要检验亚铁离子应该用酸性高锰酸钾溶液检验,避免使用KSCN。所以操作方法为:取少量滤液,滴加KMnO4溶液(2分),KMnO4溶液褪色。
(3)①除杂步骤中加入高锰酸钾就是要加入氧化剂,把亚铁离子氧化为铁离子,在调节PH值到3.2,好让铁离子完全沉淀除去,同时不使其他离子沉淀。
②若步骤II所得的沉淀中含有二氧化锰,则往沉淀中加入浓盐酸,则会发生我们熟悉的实验室制备氯气的反应,因此可以观察到有黄绿色气体产生,方程式为MnO2+4HCl= MnCl2+ Cl2↑+2H2O。
③步骤II所得的上层溶液显紫红色,所以溶液中含有MnO4 - ,MnO4 -可与Mn2+反应生成MnO2 ,所以加入MnS04的目的是出去过量的MnO4- 。
(4)除杂步骤除去了杂质离子,不断循环后,循环液中含有大量的高锰酸钾反应剩下的钾离子,同时加入了MnSO4,所以还剩有硫酸根离子。因此主要物质是硫酸钾。
考点:本题考查的简单的化学工艺流程题。

下列不属于海水淡化方法的是:
| A.蒸馏法 | B.过滤法 | C.电渗析法 | D.离子交换法 |
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: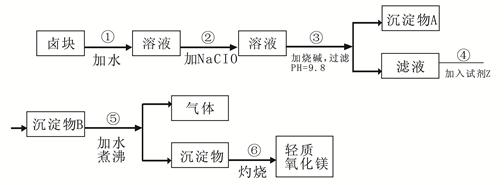
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
(1)在步骤②中加入漂液而不是双氧水其原因是 。
写出加入NaClO发生反应的离子方程式 。
(2)在步骤③中控制pH=9.8,其目的是 。
(3)沉淀物A的成分为 ,试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在 (填仪器名称)中灼烧。
高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下:
请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式 ;
(2)生成“反应液Ⅱ”的离子方程式是 ;(3)使用碱性KClO的原因是 ;
(4)从“反应液II”中分离出K2FeO4后 ,副产品是KCl和 (填化学式),该混合物可用 方法分离提纯(填字母序号);
| A.过滤 | B.分液 | C.蒸馏 | D.重结晶 |




 固体加热脱水通常要通入 。
固体加热脱水通常要通入 。 。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。
。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。


 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。