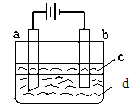
题目内容
用下图(Ⅰ)装置加入稀硝酸和铜片,在实验室里制备NO,在烧瓶中实际见到的气体是红棕色的,这就使人怀疑稀硝酸与铜反应是否真能生成NO。即使可用排水取气法收集到NO,也可以认为是NO2与水反应生成了NO而无法证实。现用U形管、分液漏斗、酒精灯、胶塞等仪器,设计下图(Ⅱ)装置,来证实稀硝酸与铜反应的确生成了NO而不是NO2。
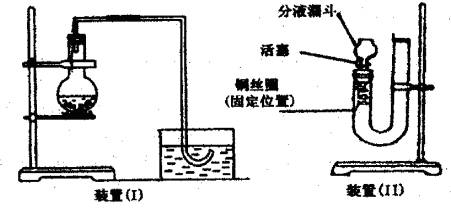
(1)补充完成实验步骤:
a.检验装置的气密性
b.将活塞打开,从U形管长管口注入稀硝酸,一直注到 为止。
c.关闭活塞,用酒精灯在 加热,当观察到 时,立即撤去酒精灯。
(2)观察实验现象
(Ⅰ)可以在何处观察到无色的NO气体? 。反应在什么情况下可以自动停止?(铜丝与稀HNO3均未反应完) 。
(Ⅱ)如果再将活塞慢慢打开,可立即观察到明显现象有 。通过以上两个过程可以获得NO与NO2鲜明对照的实验效果。
(3)若用装置(2)制取并收集NO,应对装置作何简单的改动?
。
解析:
(1)单孔塞下沿且液面上不再有气泡;U形管短管一侧;铜丝上有气泡产生 (2)U形管短管一侧上方;当产生的NO将稀硝酸排入长管,使铜与稀硝酸脱离接触;长管中稀硝酸又回落到短管内,分液漏斗中有红棕色气体出现。 (3)将分液漏斗改为玻璃导管(用排水法收集)
|
提示:
对比左图,装置Ⅱ中盛放反应物铜和稀硝酸的容器由烧瓶换成U形管,装置Ⅰ烧瓶内液面上的空间充满空气,相当于装置Ⅱ中的分液漏斗部分,活塞将两部分分开。关闭活塞即可避免产生的气体与空气接触。所以若生成气体为无色,即为NO,若产生的气体为红棕色,则为NO2。 在检查装置的气密性后,将活塞打开与大气相通,从U形管的长管口注入稀硝酸,应赶尽U形管中的空气,以防生成的NO与其反应变成NO2。所以稀硝酸应一直注入到单孔塞下沿,使液面上不再有气泡。 关闭活塞,用酒精灯在有药品的一侧加热,由于此反应为放热反应,当提供的热量使反应启动后,即观察到铜丝上有气泡生成时,立即停止加热。由于NO不溶于水,产生的NO聚集在U形管短管一侧的胶塞下面,将稀硝酸排入长管,直至使铜与稀硝酸脱离接触,反应自动停止。如果再将活塞慢慢打开,NO逸出,与空气接触生成红棕色NO2,U形管内外压强相等,使长管中硝酸又回落到短管内。 若用此装置制取并收集NO,将出气口分液漏斗改为玻璃导管,用排水法收集即可。
|

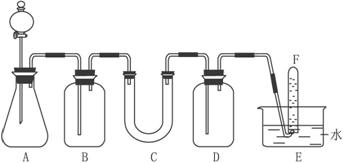
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:_________________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 |
|
C |
|
|
D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式:___________________________________。
(4)试管F中收集满气体后,下一步实验操作是:___________________________________。

 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.某课外小组模拟其原理选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.某课外小组模拟其原理选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2.