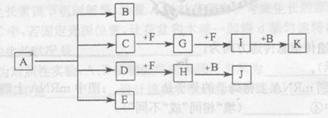
题目内容
A、B、C、D、E、F六种元素为元素周期表中的前20号元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;Cˉ离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍;E的氯化物ECl2 1.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,且E的核内中子数为20;F的最高价氧化物对应的水化物可以与其氢化物发生反应生成盐。请填写下列空格:
(1)推断A、B、C、D、E、F六种元素的符号A_________;B_________;C________;D________; E_________;F_________
(2)C的一价阴离子的结构示意图__________________;
(3)D元素的最高价氧化物的结构式是_______________;
(4)C、D两元素形成的化合物电子式______________,分子内含有_______键(填极性或非极性)。
(5)55.5g ECl2中所含质子的物质的量为__________mol。
(1)推断A、B、C、D、E、F六种元素的符号A_________;B_________;C________;D________; E_________;F_________
(2)C的一价阴离子的结构示意图__________________;
(3)D元素的最高价氧化物的结构式是_______________;
(4)C、D两元素形成的化合物电子式______________,分子内含有_______键(填极性或非极性)。
(5)55.5g ECl2中所含质子的物质的量为__________mol。
(13分)(1)(每空1分)Mg;Al;Cl;C;Ca;N;(2) (每空1分)Cl- 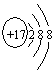 ;(3)O=C=O(1分);
;(3)O=C=O(1分);
(4)(每空2分)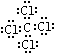 ;极性;(5)(1分)27
;极性;(5)(1分)27
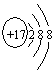 ;(3)O=C=O(1分);
;(3)O=C=O(1分);(4)(每空2分)
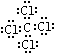 ;极性;(5)(1分)27
;极性;(5)(1分)27试题分析:0.5molA的元素的离子得到NA个电子后被还原为中性原子,则A是第ⅡA族元素。0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应,所以0.4gA的氧化物的物质的量是0.01mol,所以该氧化物的相对分子质量是40,则A的相对原子质量是24。又因为A元素原子核内质子数与中子数相等,所以A的质子数是12,即A是Mg。B元素原子核外电子数比A元素原子核外电子数多1,则B是Al。Cˉ离子核外电子层数比A元素的离子核外电子层数多1,因此C是氯元素。D元素原子最外层电子数是次外层电子数的2倍,则D是碳元素。E的氯化物ECl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,则化合物中氯离子的物质的量是0.02mol,所以该氯化物的物质的量是0.01mol,因此氯化物的相对分子质量是111,则E的相对原子质量是111-71=40.又因为E的核内中子数为20,所以质子数是20,即E是Ca元素。F的最高价氧化物对应的水化物可以与其氢化物发生反应生成盐,因此F是氮元素。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。

练习册系列答案
相关题目