题目内容
 下列实验过程中产生的现象与座标图形相符合的是( )
下列实验过程中产生的现象与座标图形相符合的是( )分析:A.根据氢氧化钠和氯化钠的电离程度判断;
B.根据反应Fe+CuSO4═FeSO4+Cu判断;
C.根据方程式CO2+2NaOH=Na2CO3+H2O、Na2CO3+CO2+H2O=2NaHCO3判断;
D.向Ba(OH)2溶液中加入稀硫酸反应的方程式为Ba(OH)2+H2SO4═BaSO4↓+2H2O,据此判断.
B.根据反应Fe+CuSO4═FeSO4+Cu判断;
C.根据方程式CO2+2NaOH=Na2CO3+H2O、Na2CO3+CO2+H2O=2NaHCO3判断;
D.向Ba(OH)2溶液中加入稀硫酸反应的方程式为Ba(OH)2+H2SO4═BaSO4↓+2H2O,据此判断.
解答:解:A.HCl+NaOH=NaCl+H2O,氢氧化钠和氯化钠都是强电解质,在水中完全电离,所以钠离子的物质的量不变,而图象中的钠离子先变小后变大,故A错误;
B.铁粉加到一定量CuSO4溶液中Fe+CuSO4═FeSO4+Cu,根据方程式知每当消耗56克铁,生成64克固体,所以固体的质量一直在增加,而图象中的固体的质量先变小后变大,故B错误;
C.CO2通入一定量NaOH溶液中,发生的化学反应是CO2+2NaOH=Na2CO3+H2O、Na2CO3+CO2+H2O=2NaHCO3,根据方程式知钠离子浓度基本不变,所以导电能力基本不变,故C错误;
D.滴入的硫酸与氢氧化钡反应,生成硫酸钡沉淀和水,溶液中离子浓度减少,导电能力下降,恰好完全反应导电性变为零,再随着稀硫酸的滴入,溶液导电能力增加,直到变为定值,故D正确;
故选D.
B.铁粉加到一定量CuSO4溶液中Fe+CuSO4═FeSO4+Cu,根据方程式知每当消耗56克铁,生成64克固体,所以固体的质量一直在增加,而图象中的固体的质量先变小后变大,故B错误;
C.CO2通入一定量NaOH溶液中,发生的化学反应是CO2+2NaOH=Na2CO3+H2O、Na2CO3+CO2+H2O=2NaHCO3,根据方程式知钠离子浓度基本不变,所以导电能力基本不变,故C错误;
D.滴入的硫酸与氢氧化钡反应,生成硫酸钡沉淀和水,溶液中离子浓度减少,导电能力下降,恰好完全反应导电性变为零,再随着稀硫酸的滴入,溶液导电能力增加,直到变为定值,故D正确;
故选D.
点评:本题考查了化学反应及图象的关系,较为综合,解题的重点是能正确分析变化过程,读懂图象并与反应相结合是解题的关键,题目难度中等.

练习册系列答案
相关题目
如图,下列实验过程中产生的现象与所给图形相符合的是( )
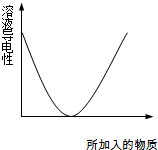

| A、往乙酸中通入氨气 | B、往Ba(OH)2溶液中滴加硫酸 | C、往氢硫酸溶液中通入氯气 | D、往NaOH溶液中通入过量CO2 |
下列实验过程中产生的现象与对应的图形符合的是( )
A、 盐酸溶液中加入NaAlO2 | B、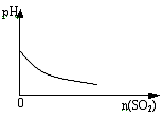 SO2气体通入溴水中 | C、 PH=2的醋酸与盐酸溶液分别加水稀释 | D、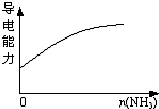 氨气通入醋酸溶液中 |