题目内容
如图,下列实验过程中产生的现象与所给图形相符合的是( )
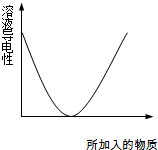

| A、往乙酸中通入氨气 | B、往Ba(OH)2溶液中滴加硫酸 | C、往氢硫酸溶液中通入氯气 | D、往NaOH溶液中通入过量CO2 |
分析:溶液的导电与溶液中离子浓度大小有关,根据图象可知,开始时随着加入的物质增多,溶液导电性逐渐减弱,直至为0,说明溶液中离子浓度逐渐减小,最后离子浓度接近0,说明此时二者恰好反应;然后再加入该物质,溶液的导电性逐渐增强,说明溶液中该物质电离出的离子浓度逐渐增大,据此进行解答.
解答:解:A、往乙酸中通入氨气,反应生成强电解质醋酸铵,溶液的导电性逐渐增强,与图象溶液的导电性逐渐减弱不符,故A错误;
B、往Ba(OH)2溶液中滴加硫酸,反应生成了硫酸钡沉淀和水,溶液中离子浓度逐渐减小,直至二者恰好反应,溶液中离子浓度接近0,此时溶液导电性最小,然后再加入硫酸,溶液中离子浓度逐渐增大,溶液的导电性逐渐增强,此实验过程中产生的现象与所给图形相符合,故B正确;
C、氢硫酸为弱电解质,通过氯气后发生了氧化还原反应生成了硫单质和氯离子,溶液的导电性增强,此现象与图象导电性逐渐减小不符,故C错误;
D、往NaOH溶液中通入过量CO2,开始时生成碳酸钠,溶液导电性基本不变,然后生成碳酸氢钠,溶液导电性也是基本不变,当反应完全后,再通入二氧化碳,溶液的导电性基本不再变化,此过程现象与图象不符,故D错误;
故选B.
B、往Ba(OH)2溶液中滴加硫酸,反应生成了硫酸钡沉淀和水,溶液中离子浓度逐渐减小,直至二者恰好反应,溶液中离子浓度接近0,此时溶液导电性最小,然后再加入硫酸,溶液中离子浓度逐渐增大,溶液的导电性逐渐增强,此实验过程中产生的现象与所给图形相符合,故B正确;
C、氢硫酸为弱电解质,通过氯气后发生了氧化还原反应生成了硫单质和氯离子,溶液的导电性增强,此现象与图象导电性逐渐减小不符,故C错误;
D、往NaOH溶液中通入过量CO2,开始时生成碳酸钠,溶液导电性基本不变,然后生成碳酸氢钠,溶液导电性也是基本不变,当反应完全后,再通入二氧化碳,溶液的导电性基本不再变化,此过程现象与图象不符,故D错误;
故选B.
点评:本题考查了溶液导电性与离子浓度的关系,题目难度中等,解题的重点是能正确分析变化过程,读懂图象并与反应相结合是解题的关键.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目


