题目内容
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设:
假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图: 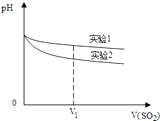
实验1中溶液pH变小的原因是;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
实验4: |
【答案】
(1)无现象;白色沉淀生成
(2)SO2溶于水后生成H2SO3 , 亚硫酸显酸性,故pH值减小;3SO2+2H2O+2NO3﹣=2NO+4H++3SO42﹣
(3)无现象;在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体;有白色沉淀生成;假设二成立
【解析】解:(1)因盐酸的酸性大于亚硫酸,则二氧化硫与氯化钡不反应,则实验1中无现象;
Ba(NO3)2溶液中缓慢通入纯净的SO2气体,发生氧化还原反应生成硫酸钡沉淀,则实验2中生成白色沉淀,假设一成立,
所以答案是:
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 白色沉淀生成 |
·(2)实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3 , 亚硫酸显酸性,故pH值减小;实验2中溶液pH小于实验1的原因是3SO2+2H2O+2NO3﹣=2NO+4H++3SO42﹣ ,
所以答案是:SO2溶于水后生成H2SO3 , 亚硫酸显酸性,故pH值减小;3SO2+2H2O+2NO3﹣=2NO+4H++3SO42﹣;(3)设计实验验证假设二,实验3与4为对比实验,实验4中未经脱O2处理,实验4中出现白色沉淀,实验3中无现象可知假设二成立,
所以答案是:
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设二成立 |
实验4:在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 有白色沉淀生成 |

 阅读快车系列答案
阅读快车系列答案