题目内容
(2010?南昌二模)A-M均代表中学化学中常见物质,它们具有如下转化关系: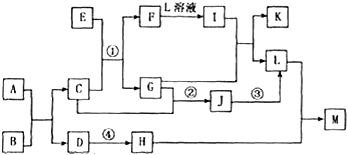
已知:(1)①②③是某化工生产的反应原理;(2)I遇苯酚溶液呈现紫色;
(3)H在过量的L溶液中生成白色胶状沉淀M;(4)反应④是工业上生产玻璃原理之一;
根据以上信息回答下列问题:
(1)写出E的名称:
(2)I与G反应的离子方程式:
(3)反应④的化学方程式:
(4)已知3.2gG与C完全反应生成气态J放出QkJ的热量,则该反应的热化学方程式为:

已知:(1)①②③是某化工生产的反应原理;(2)I遇苯酚溶液呈现紫色;
(3)H在过量的L溶液中生成白色胶状沉淀M;(4)反应④是工业上生产玻璃原理之一;
根据以上信息回答下列问题:
(1)写出E的名称:
二硫化亚铁(黄铁矿,硫铁矿)
二硫化亚铁(黄铁矿,硫铁矿)
;(2)I与G反应的离子方程式:
2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
;(3)反应④的化学方程式:
Na2CO3+SiO2
Na2SiO3+CO2↑,
| ||
Na2CO3+SiO2
Na2SiO3+CO2↑,
;
| ||
(4)已知3.2gG与C完全反应生成气态J放出QkJ的热量,则该反应的热化学方程式为:
2SO2(g)+O2(g)=2SO3(g)△H=-40QkJ/mol
2SO2(g)+O2(g)=2SO3(g)△H=-40QkJ/mol
;工业生产完成该反应的设备名称是接触室
接触室
.分析:I遇苯酚溶液呈现紫色,I为中含铁离子,H在过量的L溶液中生成白色胶状沉淀M,且反应④是工业上生产玻璃原理之一,则L为硫酸,H为Na2SiO3,M为H2SiO3,结合图中转化关系可知,F为Fe,①为制取二氧化硫,J为三氧化硫,即①②③是某化工生产硫酸的反应原理,则E为二硫化亚铁(黄铁矿,硫铁矿),C为O2,I为硫酸铁,G为SO2,D为碳酸钠,A、B应为过氧化钠、二氧化碳中的一种,然后结合物质的性质及化学用语来解答.
解答:解:I遇苯酚溶液呈现紫色,I为中含铁离子,H在过量的L溶液中生成白色胶状沉淀M,且反应④是工业上生产玻璃原理之一,则L为硫酸,H为Na2SiO3,M为H2SiO3,结合图中转化关系可知,F为Fe,①为制取二氧化硫,J为三氧化硫,即①②③是某化工生产硫酸的反应原理,则E为二硫化亚铁(黄铁矿,硫铁矿),C为O2,I为硫酸铁,G为SO2,D为碳酸钠,A、B应为过氧化钠、二氧化碳中的一种,
(1)由上述分析可知,E为二硫化亚铁(黄铁矿,硫铁矿),故答案为:二硫化亚铁(黄铁矿,硫铁矿);
(2)I与G反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(3)反应④的化学方程式为Na2CO3+SiO2
Na2SiO3+CO2↑,故答案为:Na2CO3+SiO2
Na2SiO3+CO2↑;
(4)3.2gG(n=
=0.05mol)与C完全反应生成气态J放出QkJ的热量,则2molG反应放出40Q的热量,该热化学反应为2SO2(g)+O2(g)=2SO3(g)△H=-40QkJ/mol,工业生产完成该反应的设备名称是接触室,故答案为:2SO2(g)+O2(g)=2SO3(g)△H=-40QkJ/mol;接触室.
(1)由上述分析可知,E为二硫化亚铁(黄铁矿,硫铁矿),故答案为:二硫化亚铁(黄铁矿,硫铁矿);
(2)I与G反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(3)反应④的化学方程式为Na2CO3+SiO2
| ||
| ||
(4)3.2gG(n=
| 3.2g |
| 64g/mol |
点评:本题考查无机物的推断,把握接触法制备硫酸为解答本题的关键,注意铁离子检验、硅酸性质及硫酸制备涉及的反应,物质的推断为解答的难点,题目难度较大.

练习册系列答案
相关题目
 (2010?南昌二模)已知可逆反应:2A(g)+B(g)?3C(g)+D(s);△H<0.A的转化率与时间关系如图所示:a、b曲线表示不同条件下A的转化率与时间变化关系.下列有关叙述正确的是( )
(2010?南昌二模)已知可逆反应:2A(g)+B(g)?3C(g)+D(s);△H<0.A的转化率与时间关系如图所示:a、b曲线表示不同条件下A的转化率与时间变化关系.下列有关叙述正确的是( )