题目内容
【题目】常温下,向20.00mL0.100mol·L-1NH4Cl溶液中逐滴加入0.100 mol·L-1NaOH溶液,溶液的pH与NaOH溶液所加入体积的关系如图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B. 点②所示溶液中:c(Cl-)>c(Na+)>c(NH4+)>c(NH3·H2O)
C. 点③所示溶液中:c(Cl-)>c(NH3·H2O)>c(OH-)>c(NH4+)
D. 整个过程中可能出现:c(OH-)+c(Cl-)= c(NH4+)+c(NH3·H2O)
【答案】C
【解析】A. 点①所示溶液中pH=7,c(H+)=c(OH-),由电荷守恒知, 溶液中阳离子还有铵根,所以c(Cl-)> c(Na+),A不正确;B. 点②所示溶液中pH>7,恰好有一半氯化铵发生反应NH4Cl+NaOH= NH3·H2O +NaCl,因为溶液显碱性,所以一水合氨的电离作用超过了铵根的水解作用,c(Cl-) > c (NH4+) >c(Na+) >c(NH3·H2O),B不正确;C. 点③所示溶液中两者恰好完全反应得到氯化钠和氨水,由于一水合氨及水的电离平衡的存在,所以c(Cl-)>c(NH3·H2O)>c(OH-)>c(NH4+),C正确;D.由物料守恒知,c(Cl-)= c(NH4+)+c(NH3·H2O), 整个过程中不可能出现c(OH-)+c(Cl-)= c(NH4+)+c(NH3·H2O),D不正确。本题选C。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作规范且能达到实验目的的是
实验目的 | 实验操作 | |
A | 称取2.0gNaOH固体 | 先在两盘上各放一张滤纸,然后右盘添加2g砝码,左盘加入NaOH至两盘平衡 |
B | 除去CO2中的SO2 | 将混合气体通入饱和Na2CO3溶液中 |
C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴加CaCl2溶液,观察颜色变化 |
D | 测定硫酸浓度 | 向洁净的锥形瓶中加入20.00mL待测硫酸,用0.1000mol/L的NaOH标准液滴定 |
A. A B. B C. C D. D
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应Ⅲ是反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.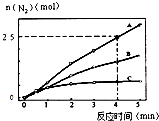
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2);恒温恒容容器,φ(NO2) .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则: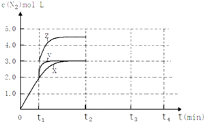
①变为曲线Y改变的条件是 . 变为曲线Z改变的条件是
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2﹣t4内 c(N2)的变化曲线.
【题目】无机化合物可根据其组成和性质进行分类, 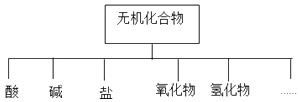
(1)如图所示的物质分类方法名称是 .
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑩后面.
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 | ③NaOH | ⑤Na2SO4 | ⑦SO2 | ⑨NH3 |
(3)SO2和CO2都属于酸性氧化物,在化学性质上有很多相似的地方,请写出少量的⑦与③反应的化学反应方程式为: .
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于盐(填正盐、酸式盐或碱式盐).