题目内容
【题目】填写下列空白:
(1)标准状况下,1.1 g某气态氧化物RO2的体积为0.56 L。该气体的摩尔质量是 。
(2)标准状况下,密度为1.25 g·L-1的CO2与CH4组成的混合气体中,CO2的体积分数为 ,该混合气体对氢气的相对密度为 。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n= 。
(4)将标准状况下体积为a L的HCl气体溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度为 mol/L。
【答案】(1)44 g·mol-1 (2)![]() 或42.86% 14
或42.86% 14
(3)![]() (4)
(4)![]()
【解析】
试题分析:(1)根据题意,先由![]() 计算气体的n为
计算气体的n为![]() mol或0.025 mol,再由
mol或0.025 mol,再由![]() 计算该氧化物的M为
计算该氧化物的M为![]() g/mol = 4 4 g/mol;(2)先由M =
g/mol = 4 4 g/mol;(2)先由M = 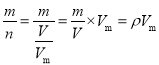 可知,混合气体的平均摩尔质量为1.25×22.4g/mol=28g/mol;再设混合气体中CO2、CH4的物质的量分数或体积分数为x、1-x,则1mol混合气体的质量即等于28g,也等于44x+16(1-x) g,则44x+16(1-x) = 28,解得:x=
可知,混合气体的平均摩尔质量为1.25×22.4g/mol=28g/mol;再设混合气体中CO2、CH4的物质的量分数或体积分数为x、1-x,则1mol混合气体的质量即等于28g,也等于44x+16(1-x) g,则44x+16(1-x) = 28,解得:x=![]() 或42.86%;由
或42.86%;由![]() 可知,同温同压下,该混合气体对氢气的相对密度 =
可知,同温同压下,该混合气体对氢气的相对密度 = ![]() = 14;(3)先由题意和
= 14;(3)先由题意和![]() 可知,A、H2O的物质的量分别为
可知,A、H2O的物质的量分别为![]() mol、
mol、![]() mol,再由化学方程式A·nH2O
mol,再由化学方程式A·nH2O ![]() A + nH2O中水和A的系数之比等于物质的量之比可知,n =
A + nH2O中水和A的系数之比等于物质的量之比可知,n =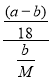 =
=![]() ;(4)先由
;(4)先由![]() 可知,溶质的物质的量为
可知,溶质的物质的量为![]() mol,再由nM可知,溶质的质量为
mol,再由nM可知,溶质的质量为![]() g,然后由m(溶质)+m(溶剂)=m(溶液)、
g,然后由m(溶质)+m(溶剂)=m(溶液)、![]() =V(溶液)可知,V(溶液) =
=V(溶液)可知,V(溶液) = 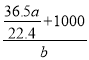 mL =
mL = 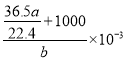 L;最后由
L;最后由![]() 可知,溶质的物质的量浓度为
可知,溶质的物质的量浓度为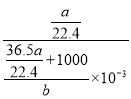 mol/L =
mol/L =![]() mol/L。。
mol/L。。

【题目】
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL