题目内容
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH如下表:
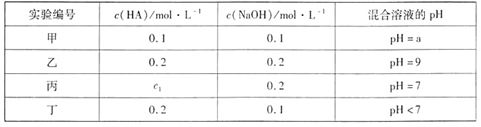
下列判断正确的是 ( )

下列判断正确的是 ( )
| A.a>9 |
| B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1 |
| C.c1=0.2 |
| D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) |
B
由乙看出,等体积,等浓度,中和后为碱性,说明HA为弱酸;
A、甲和乙比较,甲浓度小,水解程度大,但最终水解生成的氢氧根减小,故a<9;错误;
B、因pH=9,为水解得到,全部为水电离。c(OH-)=10-5mol·L-1;B正确;
C、如果C1=0.2mol/L,溶液呈碱性,先呈中性,说明酸过量。C1>0.2mol/L;错误;
D、中和后酸过量,c(HA)=c(NaA),溶液呈酸性,电离大于水解;故有c(A-)>c(Na+)> c(H+)>c(OH-),错误。
A、甲和乙比较,甲浓度小,水解程度大,但最终水解生成的氢氧根减小,故a<9;错误;
B、因pH=9,为水解得到,全部为水电离。c(OH-)=10-5mol·L-1;B正确;
C、如果C1=0.2mol/L,溶液呈碱性,先呈中性,说明酸过量。C1>0.2mol/L;错误;
D、中和后酸过量,c(HA)=c(NaA),溶液呈酸性,电离大于水解;故有c(A-)>c(Na+)> c(H+)>c(OH-),错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ③HNO3 ④CH
③HNO3 ④CH
 述五种溶液中分别加入AlCl3溶液,有气泡产生的是 (填编号),写出能产生气泡现象的离子方程式: .
述五种溶液中分别加入AlCl3溶液,有气泡产生的是 (填编号),写出能产生气泡现象的离子方程式: .