题目内容
已知:P4(s)+6Cl2(g)→4PCl3(g)+a kJ,P4(s)+10Cl2(g)→4PCl5(g)+b kJ.P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ?mol-1,PCl3中P-Cl键的键能为1.2c kJ?mol-1.下列叙述正确的是( )
| A、P-P键的键能大于P-Cl键的键能 | ||
| B、可求Cl2(g)+PCl3(g)→PCl5(s)的反应热 | ||
C、Cl-Cl键的键能为
| ||
D、P-P键的键能为
|
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、依据P和Cl原子半径大小比较键长得到键能大小,键长越长,键能越小;
B、依据盖斯定律分析判断;
C、依据焓变=反应物键能之和-生成物键能之和计算分析;
D、由P4是正四面体可知1molP4中含有3molP-P键.依据焓变=反应物键能之和-生成物键能之和计算分析.
B、依据盖斯定律分析判断;
C、依据焓变=反应物键能之和-生成物键能之和计算分析;
D、由P4是正四面体可知1molP4中含有3molP-P键.依据焓变=反应物键能之和-生成物键能之和计算分析.
解答:
解:A、原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,故A错误;
B、利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=
KJ?mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,故B错误;
C、利用Cl2(g)+PCl3(g)=PCl5(g)△H=
KJ?mol-1可得E(Cl-Cl)+3×1.2c-5c=
,因此可得E(Cl-Cl)=
kJ?mol-1,故C正确;
D、由P4是正四面体可知1molP4中含有6molP-P键,由题意得6E(P-P)+10×
-4×5c=b,解得E(P-P)=
kJ?mol-1,故D错误;
故选:C.
B、利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=
| b-a |
| 4 |
C、利用Cl2(g)+PCl3(g)=PCl5(g)△H=
| b-a |
| 4 |
| b-a |
| 4 |
| b-a+5.6c |
| 4 |
D、由P4是正四面体可知1molP4中含有6molP-P键,由题意得6E(P-P)+10×
| b-a+5.6c |
| 4 |
| 5a-3b+12c |
| 6 |
故选:C.
点评:本题考查了化学键与焓变定量计算关系,物质结构的分析应用,盖斯定律的计算应用,题目难度中等.

练习册系列答案
相关题目
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A、氢化铵的电子式: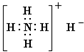 |
B、甲醇分子的球棍模型: |
| C、次氯酸分子的结构式:H-Cl-O |
D、Ge原子结构示意图: |
室温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)?c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是( )
| A、NH4+、Fe2+、NO3-、SO42- |
| B、Ba2+、Na+、Cl-、NO3- |
| C、Na+、Cl-、SO42-、HCO3- |
| D、HCO3-、Na+、AlO2-、Cl- |
下列物质中氧原子数目与11.7g Na2O2中氧原子数一定相等的是( )
| A、6.72L CO |
| B、6.6g CO2 |
| C、8 g SO3 |
| D、9.6g H2SO4 |
热还原法冶炼金属的反应一定是( )
| A、氧化还原反应 | B、置换反应 |
| C、分解反应 | D、复分解反应 |
NA为阿伏加德罗常数,下列对0.3mol/L硫酸钾溶液的说法中,正确的是( )
| A、1L溶液中含0.3NA个K+ |
| B、1L溶液中含0.9NA个离子 |
| C、2L溶液中K+浓度是1.2mol/L |
| D、2L溶液中含0.6NA个离子 |
利用银镜反应生产保温瓶胆和制镜,常用的还原剂是( )
| A、葡萄糖 | B、果糖 | C、乙醛 | D、蔗糖 |
下列说法正确的是( )
| A、互为同素异形体的物质的性质完全相同 |
| B、互为同素异形体的物质之间不可能发生相互转化 |
| C、氧气和臭氧之间的转化是物理变化 |
| D、氧气和臭氧之间的转化是化学变化 |