题目内容
7.以A、B两根石墨棒作电极,电解AgNO3溶液,通电t min,在B极收集到气体11.2mL(标准状况),然后将电源反接,以相同的电流通电$\frac{t}{2}$min,若溶液体积为200mL(设体积不变),则溶液的pH为2.分析 电解硝酸银溶液,在阳极上析出的是氧气,在阴极上产生的是金属银,在B极上共产生11.2mL(标准状况下)气体即为氧气的体积,将电极A、B与电反接,在阳极上是金属银失电子,在阴极上是银离子得电子析出金属银,不会影响pH的变化.
解答 解:在B极产生的是氧气,在阳极上析出的是氧气,在阴极上产生的是金属银,在B极上共产生11.2mL即0.0005mol氧气,根据电极反应:4OH--4e-=2H2O+O2↑,
根据H2O?H++OH-知,减少的n(OH-)是0.002mol,则溶液中n(H+)是0.002mol,c(H+)=$\frac{0.002mol}{0.2L}$=0.01mol/L,即pH=2,
故答案为:2.
点评 本题以电解原理为载体考查pH的有关计算,侧重考查学生分析计算能力,明确各个电极上发生的反应是解本题关键,注意:较活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
17. 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )| A. | x是正极,y是负极,CuSO4溶液的pH逐渐减小 | |
| B. | x是正极,y是负极,CuSO4溶液的pH保持不变 | |
| C. | x是负极,y是正极,CuSO4溶液的pH 逐渐减小 | |
| D. | x是负极,y是正极,CuSO4溶液的pH保持不变 |
18.已知某溶液中可能含有NH4+、SO32-、SO42-、NO3-及其它某些未知离子,某学生取适量试液放入试管中,然后进行如下实验并得出相应的结论,其中合理的是( )
| A. | 加入BaCl2溶液得到白色,过滤并洗涤沉淀,然后将沉淀加入到足量的稀硝酸中,沉淀无任何变化,说明该溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液得到白色,过滤并洗涤沉淀,然后将沉淀加入到足量的稀盐酸中,沉淀溶解并产生刺激性气味的气体,说明该溶液中一定含有SO32- | |
| C. | 加入1mL0.2mol/L的NaOH,将湿润的紫色石蕊试纸靠近试管口,试纸无变化,说明溶液中一定无NH4+ | |
| D. | 加入锌片后无变化,再加入适量的稀硫酸,锌片溶解并有气泡产生,该溶液中一定含有NO3- |
2.下列有机物名称中,错误的是( )
| A. | 1,2-二溴乙烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 2-丁烯 | D. | 2-甲基-3-乙基丁烷 |
16.下列物质属于非电解质的是( )
| A. | CO2 | B. | (NH4)2SO4 | C. | Cl2 | D. | CH3COOH |
17.下列各组离子在水溶液中能大量共存的是( )
| A. | CO32-、H+、HCO3-、Ca2+ | B. | NH4+、OH-、Ba2+、NO3- | ||
| C. | I-、ClO-、NO3-、H+ | D. | SO32-、SO42-、Na+、OH- |
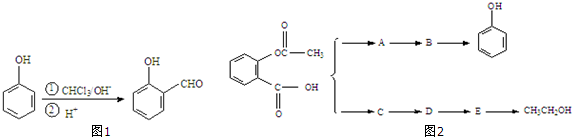
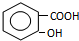 ,B
,B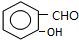 ,C
,C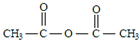 ,DCH3COOH,ECH3CHO.
,DCH3COOH,ECH3CHO.
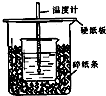 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: