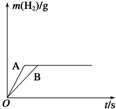
题目内容
下列实验现象与对应化学方程式都正确的是( )
| A.金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;2Na+2H2O═2NaOH+H2↑ | ||||
B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2
| ||||
| C.FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色;2Fe(OH)2+O2+H2O═2Fe(OH)3 | ||||
| D.向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
A.钠很活泼,能与水剧烈反应,钠的密度小于水,所以会浮在水面上,钠和水反应生成氢氧化钠和氢气,钠的熔点较低,钠和水反应放出热量而使钠熔成小球,生成的氢气使钠四处游动,钠和水反应后溶液呈碱性,钠和水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,故A正确;
B.纯净的氢气可以在黄绿色的氯气中安静地燃烧H2+Cl2
2HCl,发出苍白色火焰,故B错误;
C.FeSO4溶液滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,容易跟水中的氧气反应生成红棕色的氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,故C错误;
D.碳酸的酸性强于硅酸,向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,反应的化学方程式为Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl,得到透明的硅酸凝胶,故D正确;
故选AD.
B.纯净的氢气可以在黄绿色的氯气中安静地燃烧H2+Cl2
| ||
C.FeSO4溶液滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,容易跟水中的氧气反应生成红棕色的氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,故C错误;
D.碳酸的酸性强于硅酸,向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,反应的化学方程式为Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl,得到透明的硅酸凝胶,故D正确;
故选AD.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
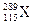 原子在生成数微秒后会衰变成
原子在生成数微秒后会衰变成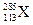 。下列有关叙述中,正确的是
。下列有关叙述中,正确的是