题目内容
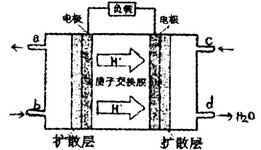
某课外活动小组同学用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
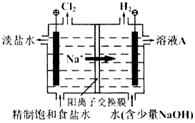
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应为 。
此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为 。
(1)Fe-2e- F
F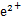
(2)2H++2e- H2↑ 2Cl-+2H2O
H2↑ 2Cl-+2H2O 2OH-+H2↑+Cl2↑ ②
2OH-+H2↑+Cl2↑ ②
(3)①4OH--4e- 2H2O+O2↑ 小于
2H2O+O2↑ 小于
②H+放电,促进水的电离,OH-浓度增大
③O2+2H2O+4e- 4OH-
4OH-
解析

 阅读快车系列答案
阅读快车系列答案化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ |
| C.①④ | D.②③ |
(3)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极由金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________。
锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:___________________________________________________。
 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;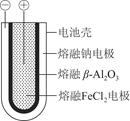




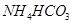 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中
 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。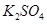 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。