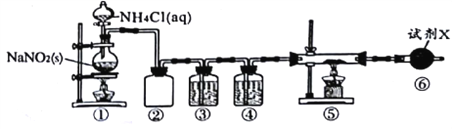
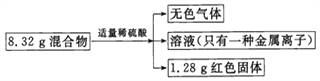
题目内容
【题目】(1)按如图所示操作,充分反应后:
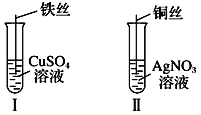
①Ⅰ中发生反应的离子方程式为______________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是___________;若反应中转移了0.3 mol电子,则氧化产物的质量是___________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=== 2Fe3++2Cl-,这个事实说明FeBr2的溶液中具有还原性粒子的还原性强弱为___________。
(4)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,2mol KNO3氧化碳的物质的量为___________。
【答案】 Fe+Cu2+===Fe2++Cu 红色铜丝上有银白色金属附着 Ag+>Cu2+>Fe2+ NO 4.8 Fe2+>Br- 2.5mol
【解析】(1)①Ⅰ中发生Fe与硫酸铜的置换反应生成Cu和硫酸亚铁,离子反应为Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
②Ⅱ中发生Cu与硝酸银的置换反应,该反应为Cu+2AgNO3=Cu(NO3)2+2Ag,观察到红色铜丝上有白色金属Ag附着,故答案为:红色铜丝上有银白色金属附着;
③由两个反应可知,得到电子的物质为氧化剂,还原剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为Ag+>Cu2+>Fe2+,故答案为:Ag+>Cu2+>Fe2+;
(2)硝酸具有强氧化性,H2S具有较强还原性,二者发生氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成S的物质的量为: ![]() =0.15mol,生成S的质量为:0.15mol×32g/mol=4.8g,故答案为:NO;4.8;
=0.15mol,生成S的质量为:0.15mol×32g/mol=4.8g,故答案为:NO;4.8;
(3)一种氧化剂与多种还原剂反应时,先与还原性强的反应,将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,Fe2+被氧化,Br-没有被氧化,则还原性:Fe2+>Br-,故答案为:Fe2+>Br-;
(4)根据反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,反应中KNO3中的N元素化合价由+5价降低到0价,KNO3是氧化剂,2mol KNO3转移电子10mol,C元素化合价由0价升高到+4价,C是还原剂,2mol KNO3氧化碳的物质的量为![]() =2.5mol,故答案为:2.5mol。
=2.5mol,故答案为:2.5mol。

【题目】1 L某混合溶液,可能含有的离子如表所示:
可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH |
可能大量含有的阴离子 | Cl-、Br-、I-、CO |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。
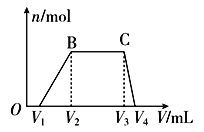
则该溶液中一定不含有的离子是________________________。
(2)BC段离子方程式为_______________________。
(3)V1、V2、V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为________。