题目内容
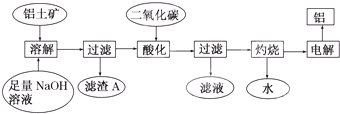
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质.
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式 ,滤渣A的主要成分为 .
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 ,通入过量的二氧化碳时,生成沉淀的离子方程式为 .
(3)电解氧化铝,每生成1molAl时,生成 g氧气.
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质.

回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是
(3)电解氧化铝,每生成1molAl时,生成
分析:(1)分析流程结合氧化铝的性质可知,铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁;
(2)氢氧化铝溶解于强酸不溶于弱酸,通入过量二氧化碳会最大程度得到氢氧化铝沉淀;过量二氧化碳通入反应生成碳酸氢根离子;
3依据电解氧化铝的化学方程式计算得到;(
(2)氢氧化铝溶解于强酸不溶于弱酸,通入过量二氧化碳会最大程度得到氢氧化铝沉淀;过量二氧化碳通入反应生成碳酸氢根离子;
3依据电解氧化铝的化学方程式计算得到;(
解答:解:(1)铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁,反应的离子方程式为:2OH-+Al2O3═2AlO2-+H2O;
故答案为:2OH-+Al2O3═2AlO2-+H2O;Fe2O3 ;
(2)氢氧化铝溶解于强酸不溶于弱酸,通入过量二氧化碳会最大程度得到氢氧化铝沉淀;过量二氧化碳通入反应生成碳酸氢根离子,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
(3)电解氧化铝的反应为2Al2O3
4Al+3O2↑,每生成1molAL,反应生成氧气物质的量
mol,质量=
mol×32g/mol=24g;
故答案为:24;
故答案为:2OH-+Al2O3═2AlO2-+H2O;Fe2O3 ;
(2)氢氧化铝溶解于强酸不溶于弱酸,通入过量二氧化碳会最大程度得到氢氧化铝沉淀;过量二氧化碳通入反应生成碳酸氢根离子,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
(3)电解氧化铝的反应为2Al2O3
| ||
| 3 |
| 4 |
| 3 |
| 4 |
故答案为:24;
点评:本题考查了铝土矿工业提纯氧化铝的流程分析和反应判断,掌握氧化铝、氢氧化铝性质是解题关键,题目难度中等.

练习册系列答案
相关题目
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程: