题目内容
加热N2O5依次发生的分解反应为:
①N2O5(g) N2O3(g)+O2(g) ②N2O3(g)
N2O3(g)+O2(g) ②N2O3(g)  N2O(g)+O2(g)
N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
①N2O5(g)
 N2O3(g)+O2(g) ②N2O3(g)
N2O3(g)+O2(g) ②N2O3(g)  N2O(g)+O2(g)
N2O(g)+O2(g)在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
| A.1.8mol/L | B.0.9 mol/L | C.2.3 mol/L | D.4.0 mol/L |
B
设平衡时剩余N2O5的物质的量是x,所以消耗N2O5是8-x,则反应①中生成N2O3和氧气都是8-x。由于平衡时O2为9 mol,所以反应②中生成氧气是1+x,则消耗N2O3是1+x,所以有(8-x)-(1+x)=3.4,解得x=1.8mol,所以浓度是0.9mol/L,答案选B。

练习册系列答案
相关题目
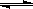 2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。
2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。 2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线如下图所示,则NH3的百分含量最低的一段时间是
2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线如下图所示,则NH3的百分含量最低的一段时间是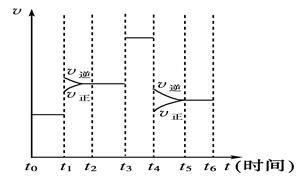
 2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( ) cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是
cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是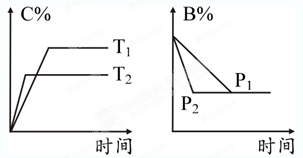
 2C(g)(正反应放热)这个可逆反应的正确图像为
2C(g)(正反应放热)这个可逆反应的正确图像为
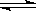 R(g)+S(s)在恒温下已达到平衡的是( )
R(g)+S(s)在恒温下已达到平衡的是( )