题目内容
一定量的锌与一定浓度的H2SO4反应,生成的气体在标准状况下体积为2.24 L,求反应消耗的锌和H2SO4的物质的量。
若气体全为H2,耗Zn 0.1 mol,耗H2SO4 0.1 mol
若气体全为SO2,耗Zn 0.1 mol,耗H2SO4 0.2 mol
若气体为SO2和H2,耗Zn 0.1 mol,耗H2SO4(0.1+ ) mol
) mol
若气体全为SO2,耗Zn 0.1 mol,耗H2SO4 0.2 mol
若气体为SO2和H2,耗Zn 0.1 mol,耗H2SO4(0.1+
 ) mol
) mol与Zn反应的硫酸的浓度未确定,因此需讨论,若为稀H2SO4,则2.24 L为H2;若为浓H2SO4,又有两种可能:一是浓H2SO4量大,则2.24 L全为SO2;若浓H2SO4量少,反应过程中浓度减小,则2.24 L为H2、SO2的混合气体。
若气体全为H2,则有:
Zn + H2SO4(稀)====ZnSO4+H2↑
1 1 1
0.1 mol 0.1 mol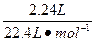 ="0.1" mol
="0.1" mol
若气体全为SO2,则有:
Zn + 2H2SO4(浓) ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
1 2 1
0.1 mol 0.2 mol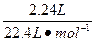 ="0.1" mol
="0.1" mol
若气体为SO2、H2的混合气体,
则n(混)=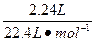 ="0.1" mol
="0.1" mol
设SO2的质量为m g,n(SO2)= mol,n(H2)=(0.1-
mol,n(H2)=(0.1- )mol。
)mol。
Zn + 2H2SO4(浓)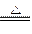 ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
1 2 1
 mol
mol  mol
mol  mol
mol
Zn + H2SO4(稀)====ZnSO4+H2↑
1 1 1
(0.1- ) mol (0.1-
) mol (0.1- ) mol (0.1-
) mol (0.1- ) mol
) mol
所以n(Zn)=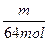 +(0.1-
+(0.1- ) mol="0.1" mol
) mol="0.1" mol
n(H2SO4)= +(0.1-
+(0.1- ) mol=(0.1+
) mol=(0.1+ )mol
)mol
若气体全为H2,则有:
Zn + H2SO4(稀)====ZnSO4+H2↑
1 1 1
0.1 mol 0.1 mol
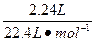 ="0.1" mol
="0.1" mol若气体全为SO2,则有:
Zn + 2H2SO4(浓)
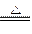 ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O1 2 1
0.1 mol 0.2 mol
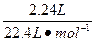 ="0.1" mol
="0.1" mol若气体为SO2、H2的混合气体,
则n(混)=
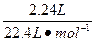 ="0.1" mol
="0.1" mol设SO2的质量为m g,n(SO2)=
 mol,n(H2)=(0.1-
mol,n(H2)=(0.1- )mol。
)mol。Zn + 2H2SO4(浓)
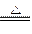 ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O1 2 1
 mol
mol  mol
mol  mol
molZn + H2SO4(稀)====ZnSO4+H2↑
1 1 1
(0.1-
 ) mol (0.1-
) mol (0.1- ) mol (0.1-
) mol (0.1- ) mol
) mol所以n(Zn)=
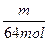 +(0.1-
+(0.1- ) mol="0.1" mol
) mol="0.1" moln(H2SO4)=
 +(0.1-
+(0.1- ) mol=(0.1+
) mol=(0.1+ )mol
)mol
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
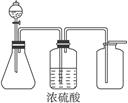
 溶液+气体;
溶液+气体;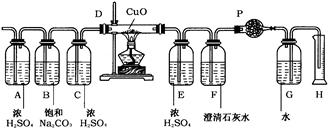


 H++
H++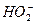 )消耗了OH-,而使酚酞褪色;乙同学认为,过氧化氢具有强氧化性,将酚酞氧化,红色消失。试设计一个简单易行的实验验证甲、乙两同学的解释哪个正确。
)消耗了OH-,而使酚酞褪色;乙同学认为,过氧化氢具有强氧化性,将酚酞氧化,红色消失。试设计一个简单易行的实验验证甲、乙两同学的解释哪个正确。