题目内容
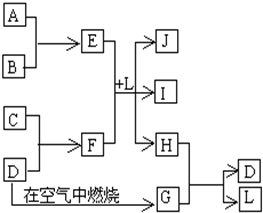
右图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)框图中所列物质中属于非电解质的物质的化学式是 ;
(2)用电子式表示出H的形成过程 ;
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学为 ;
(4)F的水溶液中各离子浓度由大到小的顺序为 ;
(5)F的水溶液显碱性的原因:(用离子方程式表示) ;
(6)E与F在L中反应的离子方程式为 ;
(7)H和G之间反应的化学方程式为 .
(1)SO2 (2)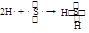 (3)Al2O3
(3)Al2O3 (4)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (5)S2-+H2O HS-+OH-
(4)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (5)S2-+H2O HS-+OH-
(6)3Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑ (7)2H2S+SO2=3S↓+H2O
解析试题分析:含金属元素的白色胶状沉淀是氢氧化铝(J),淡黄色固体单质是S。G为SO2,按框图转化可知H中含有硫元素,H与SO2生成S和L,可知H为H2S,L为H2O,由E、F、L生成Al(OH)3、NaCl、H2S可推出E为AlCl3、F为Na2S。A、B是铝和氯气,C是Na。(1)以上物质属于非电解质的是SO2。(2)用电子式表示H2S形成过程为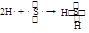 。(3)氯化铝水解生成氢氧化铝和盐酸,加热氯化铝溶液促进水解,盐酸挥发,最终得氢氧化铝固体,固体灼烧得氧化铝。(4)(5)S2-+H2O
。(3)氯化铝水解生成氢氧化铝和盐酸,加热氯化铝溶液促进水解,盐酸挥发,最终得氢氧化铝固体,固体灼烧得氧化铝。(4)(5)S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-,所以硫化钠溶液中c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。(6)氯化铝溶液与硫化钠溶液发生双水解反应生成氢氧化铝和硫化氢。(7)硫化氢与二氧化硫生成硫和水。
H2S+OH-,所以硫化钠溶液中c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。(6)氯化铝溶液与硫化钠溶液发生双水解反应生成氢氧化铝和硫化氢。(7)硫化氢与二氧化硫生成硫和水。
考点:无机推断 非电解质 用电子式表示物质的形成过程 盐类的水解 离子浓度比较 方程式的书写
点评:白色胶状沉淀一般是氢氧化铝或硅酸;淡黄色固体一般是硫或过氧化钠;Al3+水解呈酸性、S2-水解呈碱性,Al3+和S2-在溶液中发生双水解反应。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案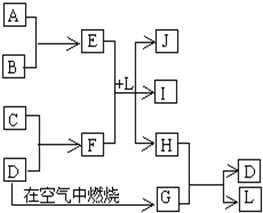 右图每一方框中的字母代表一种反应物或生成物.产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质.试填写下列空白:
右图每一方框中的字母代表一种反应物或生成物.产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质.试填写下列空白:
 HS-+OH-
HS-+OH-