题目内容
下列有关物质的性质或结构的说法正确的是( )
| A.L层上的电子数为奇数的原子一定是主族元素的原子 |
| B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 |
| C.化学键的形成一定伴随着电子的转移和能量变化 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
A
解析

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是
| A.原子半径的大小顺序:r(W)>r(Z)>r(Y) |
| B.元素Z、W的简单离子的离子半径大小:W+> Z2- |
| C.元素Y的简单气态氢化物的热稳定性比Z的强 |
| D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
已知X、Y、Z、W、T是短周期中原子序数依次增大的5种主族元素。其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物; Z原子最外层电子数是次外层电子数的3倍,W与X同主族,W与T形成的化合物WT是厨房必需的调味品。下列说法正确的是( )
| A.原子半径: T> W > Z > Y |
| B.W与T的单质可通过电解饱和的WT水溶液获得 |
| C.Z与W形成的两种化合物中化学键类型完全相同 |
| D.元素X、Z与T可形成多种酸 |
金属钛(Ti)被称为未来“钢铁”,也称为“太空金属”。对钛元素的同位素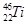 、
、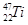 、
、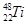 、
、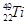 、
、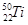 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
| A.上述同位素中,Ti原子核中的中子数不可能为30 |
| B.题述中包括5种钛元素,且质子数都为22 |
| C.题述中包括5种钛原子,即钛元素的5种核素 |
| D.钛的相对原子质量不可能为46,也不可能为50 |
短周期主族元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为19。X的简单阴离子比W的简单阴离子少2层电子,Y与Z位于相邻周期,Z的氧化物排放到空气中会形成酸雨。下列说法正确的是( )
| A.四种元素中,元素Z的非金属性最强 |
| B.X、Y、Z三种元素不可能形成离子化合物 |
| C.Y、Z、W三种元素的原子半径大小顺序:r(W)>r(Z)>r(Y) |
| D.YW3、ZW2、Z2W2中各原子最外层均达到8电子稳定结构 |
下列判断错误的是( )
| A.沸点:NH3>PH3>AsH3 |
| B.熔点:Si3N4>NaCl>SiI4 |
| C.酸性:HClO4>H2SO4>H3PO4 |
| D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列说法中正确的是( )
| A.任何元素原子的原子核都是由质子和中子构成的 |
B. 、 、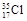 互为同位素, 互为同位素,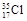 2与 2与 2互为同素异形体 2互为同素异形体 |
C.常温下,4.48 L  2含有8NA个中子(NA为阿伏加德罗常数的值) 2含有8NA个中子(NA为阿伏加德罗常数的值) |
D.O2-、Mg2+、Ne的结构示意图都可以用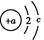 表示 表示 |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25 ℃时,0.1 mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是( )
| A.由于相对原子质量R>Y,所以X、R组成化合物的沸点高于X、Y组成的化合物 |
| B.Y和其他四种元素均可形成至少两种二元化合物 |
| C.RY2能与Y、Z形成的一种化合物反应生成Y2 |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
 ,c-l=
,c-l=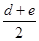 ,c-d=
,c-d=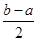 。下列说法正确的是
。下列说法正确的是