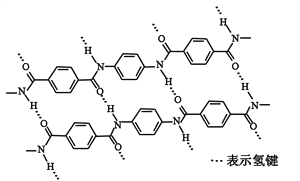
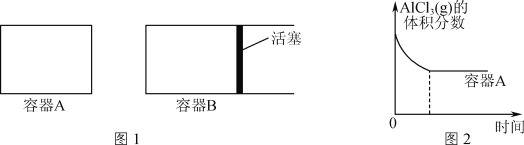
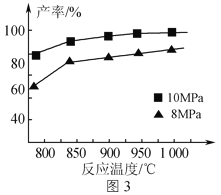
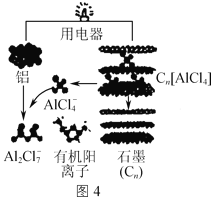
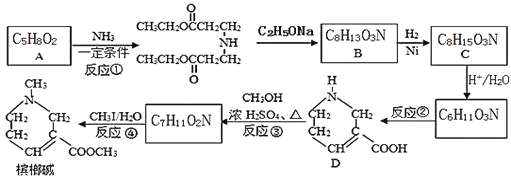
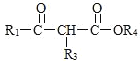
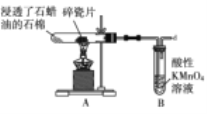
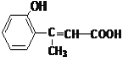题目内容
【题目】在常温下,向100mL 0.01 mol/L HA溶液中逐滴加入0.02 mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )

A. MA溶液的![]()
B. K点时加水稀释溶液,![]() 减小
减小
C. 在K点,![]()
D. 在N点,![]()
【答案】C
【解析】
A.根据0.01mol/L的HA溶液的pH判断HA;N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,据此判断MA溶液的酸碱性;
B.K点溶液呈碱性,稀释过程中氢氧根离子浓度减小,结合水的离子积不变分析氢离子浓度变化;
C.K点溶液pH>7,c(OH-)>c(H+),根据电荷守恒判断溶液中各离子浓度大小;
D.在N点时混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知c(A-)=c(M+)。
A.根据图象可知,0.01molL-1HA溶液中pH=2,则HA在溶液中完全电离,则HA为强酸;100mL0.01molL-1HA溶液中加入51mL0.02molL-1MOH溶液时,溶液的pH=7,则加入50mL该MOH溶液时,混合液为酸性,说明MOH为弱碱,则MA为强酸弱碱盐,其溶液呈酸性,MA溶液的pH<7,故A错误;
B.K点溶液呈碱性,稀释后溶液中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大,故B错误;
C.在K点时混合溶液体积是碱溶液的2倍,溶液pH>7,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒c(A-)+c(OH-)=c(H+)+c(M+)可得,c(M+)>c(A-),溶液中各离子浓度大小为:c(M+)>c(A-)>c(OH-)>c(H+),故C正确;
D.N点溶液呈中性,则c(OH-)=c(H+),根据电荷守恒c(A-)+c(OH-)=c(H+)+c(M+)可得,c(A-)=c(M+),故D错误。
故选C。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
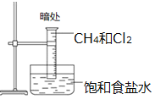
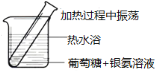
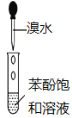
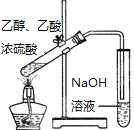
新非凡教辅冲刺100分系列答案【题目】化学实验如果设计或操作不当,可能看不到预期的现象。下列关于实验现象的分析不正确的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
现象 | 量筒中未出现油状液体 | 试管中有黑色沉淀,但未出现银镜 | 试管中未看到白色沉淀 | NaOH溶液液面上 未看到油状液体 |
原因 | 甲烷与氯气未反应 | 反应未生成单质银 | 苯酚浓度 较大 | 产物水解 |
A. AB. BC. CD. D