题目内容
(10分)某化学研究性学习小组拟测定食醋的总酸量(g/10mL),请你参与该小组 的实验并回答相关问题。
的实验并回答相关问题。
[实验目的]测定食醋的总酸量
[实验原理]中和滴定
[实验用品]蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g/100mL),0.1000mol/L NaOH标准溶液;100mL容量瓶,10mL移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
[实验步骤]
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排 除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③滴定
往盛有待测食醋溶液的锥形瓶中的滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
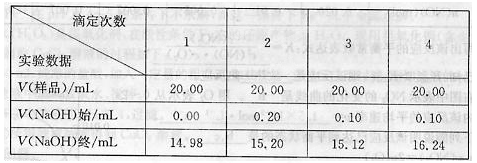
[数据记录]
[问题与思考]
(1)步骤①中用煮沸并迅速冷却的方法处理蒸馏水的目的是除去 ,防止其对实验结果的影响。
(2)步骤③中你选择的酸碱指示剂是 ,理由是 。
(3)样品总酸量= g/100mL。
(4)导致实验结果偏大的主 要原因是 (填写序号)
要原因是 (填写序号)
①滴定终点时,仰视滴定管读数
②滴定后滴定管尖嘴处悬有一滴液体
③移液管用蒸馏水洗净后,就用来 吸取待测液
吸取待测液
④滴定前,碱式滴定管无气泡,滴定后产生气泡
⑤锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水
 的实验并回答相关问题。
的实验并回答相关问题。[实验目的]测定食醋的总酸量
[实验原理]中和滴定
[实验用品]蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g/100mL),0.1000mol/L NaOH标准溶液;100mL容量瓶,10mL移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
[实验步骤]
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排
 除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。③滴定
往盛有待测食醋溶液的锥形瓶中的滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
[数据记录]

[问题与思考]
(1)步骤①中用煮沸并迅速冷却的方法处理蒸馏水的目的是除去 ,防止其对实验结果的影响。
(2)步骤③中你选择的酸碱指示剂是 ,理由是 。
(3)样品总酸量= g/100mL。
(4)导致实验结果偏大的主
 要原因是 (填写序号)
要原因是 (填写序号)①滴定终点时,仰视滴定管读数
②滴定后滴定管尖嘴处悬有一滴液体
③移液管用蒸馏水洗净后,就用来
 吸取待测液
吸取待测液④滴定前,碱式滴定管无气泡,滴定后产生气泡
⑤锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水

略

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目


 要的用途,分别是 和 ;
要的用途,分别是 和 ; 色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。 Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如
Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如 下图所示:
下图所示:
 ①称量NaCl时,物码倒置(
①称量NaCl时,物码倒置( 1 g以下用游码)________________________________
1 g以下用游码)________________________________