题目内容
用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol·L-1的稀H2SO4 100mL,配制过程中可能用到下列仪器: ①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是 ( )
| A.②⑥③⑦⑤ | B.④③⑤⑦⑥ | C.①③⑦⑤⑥ | D.②⑤⑦⑥ |
A
所需浓硫酸的体积为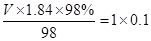 ,V=5.4ml
,V=5.4ml
首先用10mL量筒量取所需浓硫酸(用胶头滴管吸取),在烧杯中用玻璃棒搅拌稀释,冷却后移液至100mL容量瓶中,再洗涤、定容摇匀即可
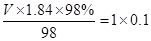 ,V=5.4ml
,V=5.4ml首先用10mL量筒量取所需浓硫酸(用胶头滴管吸取),在烧杯中用玻璃棒搅拌稀释,冷却后移液至100mL容量瓶中,再洗涤、定容摇匀即可

练习册系列答案
相关题目
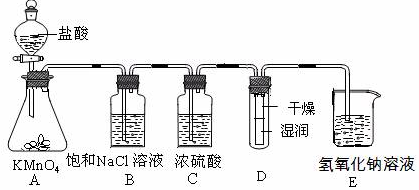
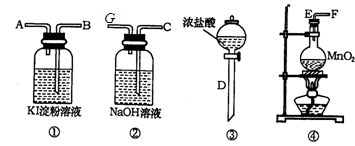
 的反应方程式:______ 。
的反应方程式:______ 。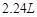 (标况下)为什么?___________________
(标况下)为什么?___________________  溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ . 烯中碳、氢两种元素的质量比。
烯中碳、氢两种元素的质量比。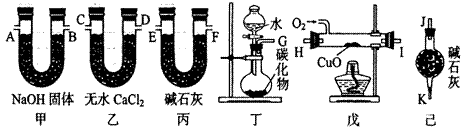
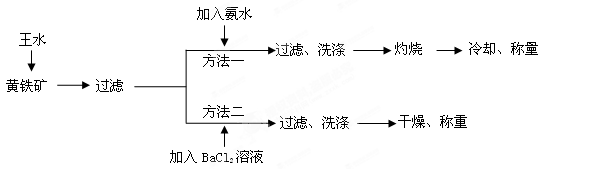
 S2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
S2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
 ,则该矿石中FeS2的质量分数是________________。
,则该矿石中FeS2的质量分数是________________。 的实验并回答相关问题。
的实验并回答相关问题。 除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。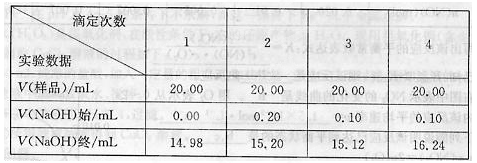
 H固体
H固体