题目内容
【题目】根据下列五种短周期元素的电离能数据(单位:kJ·mol-1),回答下列问题。

(1)在这五种元素中,最可能处于同一族的两种元素是______________(填元素符号),S元素最可能是________区元素。
(2)基态Q元素原子的价电子排布式是___________。Q和T同周期,化合物QT中T元素的化合价为____________;第一电离能介于Q、T之间的同周期元素有____________种。
(3)化合物RT3中含有的化学键类型为____________,RT3中阴离子的几何构型为__________。
(4)下列元素中,化学性质和物理性质与U元素相似的是________(填序号)。
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X的晶胞结构如图所示,晶胞参数a=0.566nm,X的化学式为________:晶体X的密度是____________(g·cm-3)。

【答案】 B和Al p 2s22p1 -3 3 离子键、共价键 直线型 D Na2O 2.27g/cm3
【解析】这五种元素的短周期元素,Q第三电离能和第四电离能相差较大,所以Q为第IIIA族元素;R元素第一电离能远远小于第二电离能,所以R元素为第IA族元素;S元素第四电离能远远大于第三电离能,则S为第IIIA族元素;T和U元素电离能没有太明显的突变,说明T和U元素最外层电子数都在5个以上,根据同周期第一电离能依次增大的原则,U的原子序数应该大于T。
(1)通过以上分析,可知最可能处于同一族的两种元素是Q和S位于第IIIA族,所以应该是B和Al元素,根据第一电离能大小判断,Q为B,S为Al,Al位于p区,故答案为: B和Al; p。
(2)Q是B元素,B的价电子排布式为2s22p1;Q和T同周期,形成化合物QT,所以T为N元素,N的化合价为-3价;因为Be的2s是全充满,N的2p半充满,所以第一电离能介于B、N之间的同周期元素有:Be、C、O,故答案为:2s22p1 ;-3 ;3。
(3)R为Na,T为N,化合物RT3为NaN3中含有的化学键类型应该是离子键和共价键;RT3中阴离子为N3-离子,N3-价电子总数为16个,与CO2为等电子体,所以空间构型为直线型,故答案为:离子键、共价键;直线型。
(4)U元素的各级电离能都比较大,最有可能是惰性气体元素,所以化学性质和物理性质与U元素相似的是氦,故选D。
(5)R为Na元素,晶胞中大球和小球的数量之比为1:2,所以该氧化物为Na2O,一个晶胞中包含了4个Na2O,晶胞参数a=0.566nm=0.566×10-8cm,由此计算晶胞的密度为: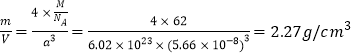

 计算高手系列答案
计算高手系列答案

