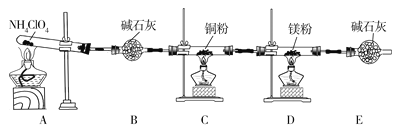
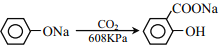
题目内容
【题目】(1)内因:___________________。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________,原因是_____________________________。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________,例如NaHCO3溶液显碱性,原因是_________________,_______________________________(离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________,_____________________(离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O![]() CH3COOH+OH-_______________
CH3COOH+OH-_______________
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | ||||
通入HCl | ||||
升温 | ||||
加水 | ||||
加NaOH | ||||
加HAc | ||||
加NH4Cl |
【答案】盐本身的性质 盐的浓度越小,水解程度越大 水解反应为吸热反应,升温促进水解 酸性 强酸酸式盐由于酸根电离大于水解,释放H+ 水解和电离的相对大小 NaHCO3溶液中水解程度大于电离程度 HCO3-+H2OH2CO3+OH-、HCO3- CO32-+H+ NaHSO3溶液中电离程度大于水解程度 HSO3-+H2OH2SO3+OH-、HSO3- SO32-+H+
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | → | ↑ | ↑ | ↑ |
通入HCl | → | ↓ | ↓ | ↑ |
升温 | → | ↓ | ↑ | ↑ |
加水 | → | ↓ | ↓ | ↑ |
加NaOH | ← | ↑ | ↑ | ↓ |
加HAc | ← | ↑ | ↓ | |
加NH4Cl | → | ↓ | ↓ | ↑ |
【解析】
(1) 影响盐类水解的内因素是盐本身的性质,据此分析;
(2)影响盐类水解的外因:浓度:盐的浓度越小,水解程度越大;温度:水解反应为吸热反应,升温促进水解;酸碱度:加入酸或碱能促进或抑制盐类的水解, 据此分析;
(3)强酸酸式盐由于酸根电离大于水解,释放H+;多元弱酸酸式盐溶液的酸碱性取决于水解和电离的相对大小,据此分析;
(4)根据勒夏特列原理和平衡CH3COO-+H2O![]() CH3COOH+OH-分析。
CH3COOH+OH-分析。
(1)影响盐类水解的内因素是盐本身的性质,故答案为:盐本身的性质;
(2)影响盐类水解的外因:浓度:盐的浓度越小,水解程度越大;温度:水解反应为吸热反应,升温促进水解;酸碱度:加入酸或碱能促进或抑制盐类的水解;故答案为:盐的浓度越小,水解程度越大;水解反应为吸热反应,升温促进水解;
(3) 强酸酸式盐由于酸根电离大于水解,释放H+,于是呈酸性;多元弱酸酸式盐溶液的酸碱性取决于水解和电离的相对大小,NaHCO3溶液显碱性,原因是HCO3-水解,反应为:HCO3-+H2OH2CO3+OH-,溶液呈碱性,同时溶液中也存在电离,电离方程式为:HCO3- CO32-+H+,溶液呈酸性,由于NaHCO3溶液中水解程度大于电离程度,因此显碱性;NaHSO3溶液显酸性的原因是HSO3-水解,反应为:HSO3-+H2OH2SO3+OH-,溶液呈碱性,同时溶液中也存在电离,电离方程式为:HSO3- SO32-+H+,溶液呈酸性,由于NaHSO3溶液中电离程度大于水解程度,因此显酸性;故答案为:酸性;强酸酸式盐由于酸根电离大于水解,释放H+;水解和电离的相对大小;NaHCO3溶液中水解程度大于电离程度;HCO3-+H2OH2CO3+OH-、HCO3- CO32-+H+;NaHSO3溶液中电离程度大于水解程度;HSO3-+H2OH2SO3+OH-、HSO3- SO32-+H+。
(4)在水解平衡 CH3COO-+H2O![]() CH3COOH+OH-中,加入CH3COONa,相当增大c(CH3COO-),促进平衡右移,水解程度增大,c(OH-)增大;通入HCl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;升温,水解过程吸热,因此升温促进平衡右移,水解程度增大,c(CH3COO-)减小,c(OH-)增大;加水,相当于溶液中所有离子都被稀释,越稀越水解,平衡右移,水解程度增大,但c(CH3COO-)减小,c(OH-)减小;加NaOH,相当于增大c(OH-),促进平衡左移,水解程度减小,c(CH3COO-)增大;加HAc,相当于增大c(CH3COOH),平衡左移,水解程度减小,c(CH3COO-)增大,c(OH-)减小;加NH4Cl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;故答案为:
CH3COOH+OH-中,加入CH3COONa,相当增大c(CH3COO-),促进平衡右移,水解程度增大,c(OH-)增大;通入HCl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;升温,水解过程吸热,因此升温促进平衡右移,水解程度增大,c(CH3COO-)减小,c(OH-)增大;加水,相当于溶液中所有离子都被稀释,越稀越水解,平衡右移,水解程度增大,但c(CH3COO-)减小,c(OH-)减小;加NaOH,相当于增大c(OH-),促进平衡左移,水解程度减小,c(CH3COO-)增大;加HAc,相当于增大c(CH3COOH),平衡左移,水解程度减小,c(CH3COO-)增大,c(OH-)减小;加NH4Cl,消耗c(OH-),相当于减小c(OH-),促进平衡右移,水解程度增大,c(CH3COO-)减小;故答案为:
改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
加入CH3COONa | → | ↑ | ↑ | ↑ |
通入HCl | → | ↓ | ↓ | ↑ |
升温 | → | ↓ | ↑ | ↑ |
加水 | → | ↓ | ↓ | ↑ |
加NaOH | ← | ↑ | ↑ | ↓ |
加HAc | ← | ↑ | ↓ | ↓ |
加NH4Cl | → | ↓ | ↓ | ↑ |
。

 阅读快车系列答案
阅读快车系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c