题目内容
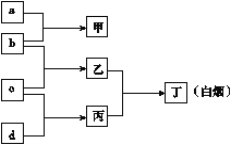
【题目】短周期元素R、X、Y、Z的原子序数依次增大, a、b、c、d是这4种元素的单质(a、b、c、d顺序不与R、X、Y、Z对应),a为生活中常见的金属,厨房中常见a金属合金餐具和器具。在甲的溶液中通入丙气体,产生白色沉淀,它们之间转化关系如图所示。
回答下列问题:
(1)写出Z元素在元素周期表中的位置______________________;
(2)写出物质丙的电子式__________________;
(3)X、Y、Z元素简单离子的半径由大到小排列的顺序为(用离子符号表示)______________;
(4)写出Y元素的氢氧化物与NaOH溶液反应的离子方程式______________________________;
(5)As(砷)与X是同族元素,位于第四周期,请写出砷原子的原子结构示意图____________。
【答案】 第三周期 第VIIA族 ![]() Cl->N3->Al3+ Al(OH)3+OH-=AlO2-+2H2O
Cl->N3->Al3+ Al(OH)3+OH-=AlO2-+2H2O 
【解析】短周期元素R、X、Y、Z的原子序数依次增大,a、b、c、d是这4种元素的单质(a、b、c、d顺序不与R、X、Y、Z对应),a为生活中常见的金属,厨房中常见a金属合金餐具和器具,a是铝。在甲的溶液中通入丙气体,产生白色沉淀,乙和丁反应产生白烟,则丙是氨气,乙是氯化氢,丁是氯化铵。所以d是氮气,c是氢气,b是氯气,甲是氯化铝。则R是H,X是N,Y是Al,Z是Cl。(1)氯元素在元素周期表中的位置为第三周期第VIIA族;(2)氨气是共价化合物,电子式为![]() ;(3)离子的核外电子层数越多,离子半径越大,核外电子排布相同时,离子半径随原子序数的增大而减小,因此X、Y、Z元素简单离子的半径由大到小排列的顺序为Cl->N3->Al3+;(4)Y元素的氢氧化物氢氧化铝与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(5)As(砷)与N是同族元素,位于第四周期,原子序数是7+8+18=33,则砷原子的原子结构示意图为
;(3)离子的核外电子层数越多,离子半径越大,核外电子排布相同时,离子半径随原子序数的增大而减小,因此X、Y、Z元素简单离子的半径由大到小排列的顺序为Cl->N3->Al3+;(4)Y元素的氢氧化物氢氧化铝与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(5)As(砷)与N是同族元素,位于第四周期,原子序数是7+8+18=33,则砷原子的原子结构示意图为 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案