题目内容
(2011?新疆二模)在热的稀硫酸溶液中溶解了11.4g硫酸亚铁固体,当加入50mL 0.5mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体.
(1)推算出 x=
(2)配平该反应的方程式:
(3)反应中氧化产物是
(1)推算出 x=
1
1
;y=1
1
.(2)配平该反应的方程式:
6
6
FeSO4+2
2
KNO3+4
4
H2SO4-3
3
K2SO4+1
1
Fe2(SO4)3+2
2
NxOy+4
4
H2O(3)反应中氧化产物是
Fe2(SO4)3
Fe2(SO4)3
.分析:(1)判断化合价降低的反应物是氧化剂、化合价升高的反应物是还原剂,根据氧化剂得到的电子等于还原剂失去的电子来求x和y;
(2)根据化合价升降总数相等和质量守恒来配平方程式;
(3)根据化合价升高的反应物是还原剂,其对应产物为氧化产物.
(2)根据化合价升降总数相等和质量守恒来配平方程式;
(3)根据化合价升高的反应物是还原剂,其对应产物为氧化产物.
解答:解:(1)n(FeSO4)=11.4g/152g?mol-1=0.075mol,KNO3的物质的量为0.05L×0.5mol?L-1=0.025mol,设NO3-与NxOy中N元素化合价差为a,根据得失电子总数相等的原则,可得关系式:0.075×1=0.025×a,所以a=3即NxOy中N元素化合价为+2价,NxOy为NO,所以x=y=1,故答案为:1;1;
(2)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O,故答案为:6;2;4;3;1;2;4;
(3)FeSO4中铁的化合价由+2价升高为+3价,是还原剂,所以对应的产物Fe2(SO4)3是氧化产物,故答案为:Fe2(SO4)3.
(2)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O,故答案为:6;2;4;3;1;2;4;
(3)FeSO4中铁的化合价由+2价升高为+3价,是还原剂,所以对应的产物Fe2(SO4)3是氧化产物,故答案为:Fe2(SO4)3.
点评:本题主要考查了氧化还原反应的配平、氧化产物、电子得失守恒的运用,难度不大,注意基础知识的掌握.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目

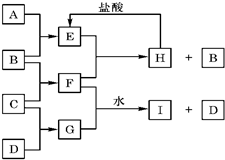 金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白:
金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白: