题目内容
15. 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1
(1)已知:2CO(g)+O2(g)?2CO2(g);△H 2
2I2(s)+5O2(g)?2I2O5(s);△H 3
则△H 1=2.5△H2-0.5△H3(用含△H 2和△H 3的代数式表示).
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图.
请回答:
①b点时化学平衡常数Kb=$\frac{c{\;}^{5}(C{O}_{2})}{c{\;}^{5}(CO)}$.
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线.
③下列说法正确的是AB.(填字母序号)
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的平均相对分子质量相等
C.增加I2O5的投料量有利于提高CO的转化率
D.b点和d点的化学平衡常数:Kb<Kd.
分析 (1)已知:①2CO(g)+O2(g)?2CO2(g);△H 2
②2I2(s)+5O2(g)?2I2O5(s);△H 3
根据盖斯定律,①×$\frac{5}{2}$--②×$\frac{1}{2}$可得:5CO(g)+I2O5(s)?5CO2(g)+I2(s);
(2)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②d点时,温度不变,若将容器体积压缩至原来的一半,反应前后气体体积不变,平衡不移动,CO2体积分数不变;
③A.所反应进行容器内气体质量增大,容器内气体密度增大,密度不变表明反应达到平衡状态;
B.两种温度下,c点时体系中二氧化碳的体积分数相等,而两种温度下体系中CO2、CO的物质的量之比相等;
C.I2O5为固体,增大其投料量不影响平衡移动;
D.平衡时b点二氧化碳体积分数大,由平衡常数表达式可知b点平衡常数更大.
解答 解:(1)已知:①2CO(g)+O2(g)?2CO2(g)△H 2
②2I2(s)+5O2(g)?2I2O5(s)△H 3
根据盖斯定律,①×$\frac{5}{2}$--②×$\frac{1}{2}$可得:5CO(g)+I2O5(s)?5CO2(g)+I2(s),则△H 1=2.5△H2-0.5△H3,
故答案为:2.5△H2-0.5△H3;
(2)①根据平衡常数的定义可知,b点时化学平衡常数的表达式Kb=$\frac{c{\;}^{5}(C{O}_{2})}{c{\;}^{5}(CO)}$,
故答案为:$\frac{c{\;}^{5}(C{O}_{2})}{c{\;}^{5}(CO)}$;
②d点时,温度不变,若将容器体积压缩至原来的一半,反应前后气体体积不变,平衡不移动,CO2体积分数不变,如图所示: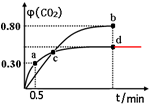 ,
,
故答案为: ;
;
③A.所反应进行容器内气体质量增大,容器内气体密度增大,密度不变表明反应达到平衡状态,故A正确;
B.两种温度下,c点时体系中二氧化碳的体积分数相等,而两种温度下体系中CO2、CO的物质的量之比相等,则平均相对分子质量相等,故B正确;
C.I2O5为固体,增大其投料量不影响平衡移动,CO的转化率不变,故C错误;
D.平衡时b点二氧化碳体积分数大,由平衡常数表达式K=$\frac{c{\;}^{5}(C{O}_{2})}{c{\;}^{5}(CO)}$,可知b点平衡常数更大,故D错误,
故选:AB.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、反应热计算等,需要学生熟练掌握基础知识并灵活应用.

 阅读快车系列答案
阅读快车系列答案| A. | H2CO3溶液中c(CO32-):c(H+) | |
| B. | NaOH+HCl=NaCl+H2O与2NaOH+H2SO4=Na2SO4+2H2O 两反应的中和热之比 | |
| C. | Na2S溶液中c(S2-):c(Na+) | |
| D. | Na2O2中阴、阳离子个数之比 |
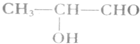 )的下列说法不正确的是( )
)的下列说法不正确的是( )| A. | 能使溴水褪色 | B. | 核磁共振氢谱有4组峰 | ||
| C. | 能氧化为二元醛 | D. | 能发生加成、消去及银镜反应 |
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ•mol-1 | |
| B. | 已知C(石墨)→C(金刚石)△H=+119kJ•mol-1,则相同条件下等质量的石墨、金刚石分别完全燃烧,石墨放出的能量比金刚石的高 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3kJ | |
| D. | 已知25℃、101 kPa条件下:4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9 kJ/mol;4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ/mol,等质量的O2比O3能量低,由O2变O3为放热反应 |
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
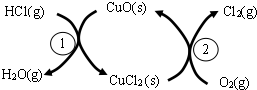 (1)盖斯定律在生产和科学研究中有很重要的意义.
(1)盖斯定律在生产和科学研究中有很重要的意义.