题目内容
2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
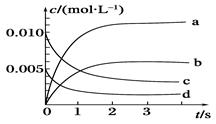
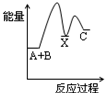
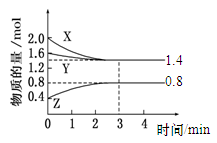
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)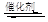 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
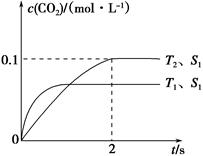
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g)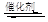 N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
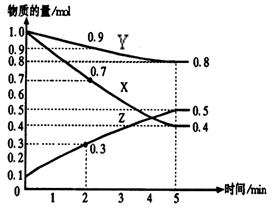
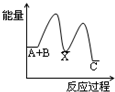
(3)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生上述的两个反应:并在t秒时测定其中NOx转化率,绘得图象如图所示:
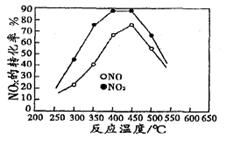
从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有 | A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |

从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
(1)①低温下 ②0.025 mol·L-1·s-1
(2)BC (3)在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小。
结论二 相同温度下NO转化效率比NO2的低
(2)BC (3)在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小。
结论二 相同温度下NO转化效率比NO2的低
试题分析;判断一个反应能否自发从吉布斯自由能的角度去判断。当吉布斯自由能小于0时,则能自发进行。由表中可知,T1达到平衡比较快。所以应该是T1大于T2。而T2生成的二氧化碳的量比较大,说明降低温度反应反应向正反应反向进行,所以正反应方向为放热反应。即ΔH小于零。而从反应物的气体量小于生成物的气体量,所以ΔS小于零而由ΔG=ΔH-TΔS要使ΔG小于零,则温度应该是在低温的情况下,所以该反应在低温下能自发进行。由表可算出二氧化碳的速率等于0. 1除以2等于0.050mol·L-1·s-1 。再据化学计量数之比等于化学反应速率之比可求出v(N2)等于0.025 mol·L-1·s-1 (2)由题意可知该反应为放热反应,降低温度,反应向正反应方向进行,减小投料比[n(NO2) / n(CH4)],相当于增大甲烷的量,减少二氧化氮的投放量,反应向正反应方向进行,因此答案选BC。(3))①在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小。

练习册系列答案
相关题目
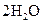 ══
══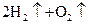
 ══
══
 ══
══
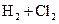 ══
══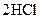

 2Z(g)
2Z(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: