题目内容
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)用单线桥表示出该反应电子转移的数目和方向_____________。
(2)氧化剂是_______。
(3)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
【答案】 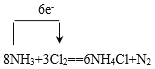 Cl2 8.5g 80.25g
Cl2 8.5g 80.25g
【解析】本题主要考查有关氧化还原反应的计算。
(1)用单线桥表示出该反应电子转移的数目和方向: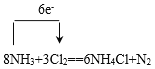 。
。
(2)Cl2中Cl的化合价降低,所以氧化剂是Cl2。
(3)每有8mol NH3参加反应,被氧化的NH3是2mol,当有34g即2molNH3参加反应时,被氧化的NH3的物质的量为0.5mol,其质量为8.5g,生成的还原产物NH4Cl的物质的量为1.5mol,其质量为80.25g。

练习册系列答案
相关题目



