题目内容
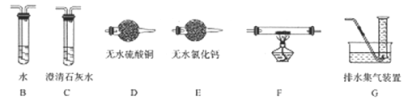
【题目】实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+![]()
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol·![]() 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知![]() )
)
【答案】(1)SO2+2OH-=SO32-+H2O,无水硫酸铜遇水变蓝。
(2)D装置中氧化铜黑色无变化,E装置中品红试液褪色。
(3)拉起铜丝,关闭K1与K2
(4)将A装置中冷却的混合溶液沿烧杯内壁缓缓倒入盛水的烧杯中,并不断搅拌,观察是否变蓝。
(5)5:4
(6)90%
【解析】试题分析:(1)F中用NaOH溶液吸收多余的SO2气体发生的离子反应方程式为SO2+2OH-=SO32-+H2O,B中无水硫酸铜遇水变蓝。(2)根据A中反应生成物进行分析,如果D中有黑色变化为红色的现象证明A有氢气生成,同样E中品红褪色证明A中生成二氧化硫。那么D装置中氧化铜黑色不变化,E装置中品红试液褪色,则可说明生成了二氧化硫气体而没有生成氢气证明浓硫酸中硫元素的氧化性强于氢元素。(3)实验结束时,撤去所有酒精灯之前为防止继续生成SO2,拉起铜丝,为防倒吸关闭K1与K2 。 (4)验证生成的溶液中含Cu2+,冷却后将A中溶液需要把试管中的液体倒入倒入盛水的烧杯中观察是否出现蓝色,若出现蓝色溶液证明含有Cu2+。(5)由氧化还原反应中电子守恒配平化学方程式可得a:b=5:4(6)n(Na2S2O3)=0.025L×0.36mol/L=0.009mol
设生成硫酸铜的物质的量为n,由反应2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-
得 Cu2+----2 S2O32-
2 2
n 0.009mol×250/25
解得 n=0.09mol
6.4g铜完全转化为硫酸铜的物质的量为6.4g/64g·mol-1=0.1mol
所以硫酸铜产率为90%。

 阅读快车系列答案
阅读快车系列答案