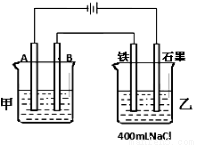
题目内容
工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:


已知:850℃ 时该反应的化学平衡常数K =1.0 ,请回答下列问题:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判断该反应达到化学平衡状态的叙述是 (填字母)。
A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中 H2 (g)的浓度不再发生改变
D.氢气的生成速率等于水的生成速率
(3)若在850 ℃时向反应容器中充人H2O(g) , K 值 (填“增大”、“减小”或“不变”)。
(4)上表中 c2为 mol/L , CO(g)的转化率为
(1)< (2)CD (3)不变 (4)0.180 60.0%
【解析】
试题分析:结合图像随温度的升高,化学平衡常数减小,确定反应为放热反应,Q<0;且K只受温度影响,所以温度不变,则K不变。利用平衡常数的表达式,可计算得表中c2的数值,及其CO的转化率。
考点:化学平衡常数及其应用、转化率。

练习册系列答案
相关题目