题目内容
(10分)运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)= ;用离子方程式表示FeCl3溶液用于净水的原因 。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。
在NaHSO4溶液中c(H+) c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为 。(已知Ksp(BaSO4)=1.1×10-10)
(4)写出下列反应的化学方程式:
苯的硝化反应 。 乙醇的催化氧化反应 。
(10分)
(1)10-2mol/L (1分) Fe3++3H2O Fe(OH)3(胶体)+3H+ (1分)
Fe(OH)3(胶体)+3H+ (1分)
(2) =(1分) >(1分)
(3) 2.2×10-8mol/L(2分) (4)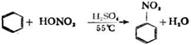 2 C2H5OH
+ O2
2 C2H5OH
+ O2 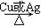 2 CH3CHO + 2H2O(各2分)
2 CH3CHO + 2H2O(各2分)
【解析】
试题分析:(1)FeCl3是强酸弱碱盐,溶于水发生水解成酸性,即Fe3++3H2O Fe(OH)3(胶体)+3H+,H+全部是由水电离生成的,pH=2,c(H+)=10-2mol/L,c(OH-)水=
c(H+)水=10-2mol/L。胶体能吸附离子,达到净水的目的。(2)在NaHSO4溶液中的H+来自水的电离和NaHSO4在水中的电离, OH-是由水的电离,c(OH-)水等于由水电离的c(H+)水,c(SO42-)等于由NaHSO4在水中的电离的H+的c(H+),因此c(H+)=c(OH-)+c(SO42-)。若溶液中SO42-完全沉淀,NaHSO4+Ba(OH)2= BaSO4↓+H2O+NaOH,反应后溶质为NaOH,呈碱性,pH>7。(3)设所需原BaCl2溶液的最小浓度为x,Ksp(BaSO4)= c(Ba2+)*
c(SO42-),1.1×10-10=(0.02/2)*(x/2),解得x=2.2×10-8mol/L。
Fe(OH)3(胶体)+3H+,H+全部是由水电离生成的,pH=2,c(H+)=10-2mol/L,c(OH-)水=
c(H+)水=10-2mol/L。胶体能吸附离子,达到净水的目的。(2)在NaHSO4溶液中的H+来自水的电离和NaHSO4在水中的电离, OH-是由水的电离,c(OH-)水等于由水电离的c(H+)水,c(SO42-)等于由NaHSO4在水中的电离的H+的c(H+),因此c(H+)=c(OH-)+c(SO42-)。若溶液中SO42-完全沉淀,NaHSO4+Ba(OH)2= BaSO4↓+H2O+NaOH,反应后溶质为NaOH,呈碱性,pH>7。(3)设所需原BaCl2溶液的最小浓度为x,Ksp(BaSO4)= c(Ba2+)*
c(SO42-),1.1×10-10=(0.02/2)*(x/2),解得x=2.2×10-8mol/L。
考点:离子浓度的计算以及大小的比较 化学方程式的书写 溶解平衡
点评:本题知识跨度较大,思考容量大。在溶液中,氢离子浓度乘以氢氧根离子的浓度等于水滴离子积常数,而由水电离的氢氧根离子的浓度等于由水电离的氢离子的浓度。NaHSO4在水中是完全电离。Ksp的计算,对于物质AnBm(s)="n" Am+(aq)+ mBn-(aq), 溶度积(Ksp)=(C(Am+) )^n ( C(Bn-))^m。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则 在水中的电离方程式为
在水中的电离方程式为
 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”) 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后: 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是