题目内容
6.标准状况下有①6.72L CH4 ②3.01×1023个HCl ③13.6g H2S ④0.2mol NH3四种气体,气体所占体积由小到大的顺序是(填序号,下同)④①③②;所含氢原子数由小到大的顺序是②④③①.分析 ①6.72L CH4,其物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(H)=0.3mol×4=1.2mol;
②3.01×1023个HCl物质的量=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol、体积=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$×22.4L/mol=11.2L,n(H)=0.5mol×1=0.5mol;
③13.6g H2S物质的量=$\frac{13.6g}{34g/mol}$=0.4mol,体积=0.4mol×22.4L/mol=8.96L,n(H)=0.4mol×2=0.8mol;
④0.2mol NH3,体积=0.2mol×22.4L/mol=4.48L,n(H)=0.2mol×3=0.6mol.
解答 解:①6.72L CH4,其物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(H)=0.3mol×4=1.2mol;
②3.01×1023个HCl物质的量=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol、体积=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$×22.4L/mol=11.2L,n(H)=0.5mol×1=0.5mol;
③13.6g H2S物质的量=$\frac{13.6g}{34g/mol}$=0.4mol,体积=0.4mol×22.4L/mol=8.96L,n(H)=0.4mol×2=0.8mol;
④0.2mol NH3,体积=0.2mol×22.4L/mol=4.48L,n(H)=0.2mol×3=0.6mol.
通过以上分析知,体积大小顺序是④①③②;H原子个数大小顺序是②④③①,故答案为:④①③②;②④③①.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量关系是解本题关键,熟练运用公式进行计算,题目难度不大.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
| A. | 16g氧气 | B. | 2g氢气 | ||
| C. | 4.48L氮气(标准状况) | D. | 6.02×1023个氯气分子 |
| A. | NA个SO2分子所占的体积约为22.4L | |
| B. | 2.3g金属钠变为钠离子时失去的电子数目为0.1NA | |
| C. | 18g水所含的电子数目为NA | |
| D. | 标准状况下,0.3molCO2中含氧分子数为0.3NA |
| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
| A. | 一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c(Clˉ)为 4.00mol•L-1,c(Al3+)为1.00 mol•L-1 | |
| D. | c(Mg2+)为 1.00mol•L-1,c(Na+)为 0.50 mol•L-1 |
| A. | LiH与D2O反应,所得氢气的摩尔质量为4g/mol | |
| B. | 1mol LiAlH4在125℃完全分解,转移3mol电子 | |
| C. | LiH与水反应的化学方程式为:LiH+H2O=LiOH+H2↑ | |
| D. | LiH与中微粒半径r(Li+)>r(H-) |
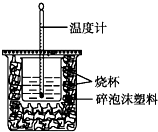 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: