题目内容
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
I.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下图所示,试回答下列问题:
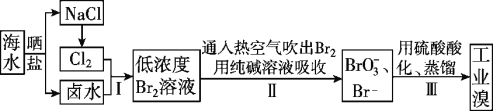
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____________。
(2)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
___Br2+___![]() =___
=___![]() +___Br-+___CO2↑
+___Br-+___CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:___________________。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:_________。
Ⅱ.目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

(6)操作A是_____________,试剂a是_____________
(7)由无水MgCl2制取Mg的化学方程式是________________________。从考虑成本和废物循环利用的角度,副产物可以用于_____________________。
【答案】富集溴元素 C 3 3 1 5 3 SO2+Br2+2H2O=4H++2Br-+SO42- 温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低 过滤 盐酸 MgCl2(熔融)![]() Mg+Cl2↑ 制盐酸
Mg+Cl2↑ 制盐酸
【解析】
I.(1)根据溴的富集原理作答;
(2)溴易挥发;
(3)根据得失电子数守恒配平化学方程式;
(4)二氧化硫还原溴单质为溴离子;
(5)根据蒸馏过程中温度对溴蒸气原料利用率的影响作答;
Ⅱ.生石灰溶于水得到氢氧化钙溶液加入沉淀池,沉淀镁离子,过滤得到氢氧化镁固体,加入稀盐酸后溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶,过滤洗涤得到氯化镁晶体,熔融电解得到金属镁,据此解答。
I.(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,再利用氯气将其氧化得到产品溴,目的是为了富集溴元素,
故答案为:富集溴元素;
(2)溴易从液态转化为气态,故步骤②通入热空气或水蒸气吹出Br2,利用了溴的挥发性,C项正确;
故答案为:C;
(3)该反应为歧化反应,Br元素一部分从0价升高到+5价,另一部分从0价降低到-1价,根据最小公倍数法配平该氧化还原反应为:3Br2+3CO![]() = BrO
= BrO![]() +5Br-+3CO2↑,
+5Br-+3CO2↑,
故答案为:3;3;1;5;3;
(4)溴与二氧化硫水溶液发生氧化还原反应,其反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(5)温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低,所以温度过高或过低都不利于生产,
故答案为:温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低;
Ⅱ.(6)操作A是是溶液中分离出固体的方法,操作为过滤;试剂a为溶解氢氧化镁得到氯化镁溶液,结合提纯目的得到需要加入盐酸,即试剂a为盐酸,
故答案为:过滤;盐酸;
(7)电解熔融氯化镁得到金属镁和氯气,方程式为MgCl2(熔融)![]() Mg+Cl2↑;从考虑成本和废物循环利用的角度,副产物氯气可以用制盐酸,循环使用,
Mg+Cl2↑;从考虑成本和废物循环利用的角度,副产物氯气可以用制盐酸,循环使用,
故答案为:MgCl2(熔融)![]() Mg + Cl2↑ ;制盐酸
Mg + Cl2↑ ;制盐酸

【题目】2 L密闭容器中进行反应:pZ(g)+qQ(g) ![]() mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知:2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
请回答下列问题:
(1)2 min内X的反应速率v(X)=__________。
(2)起始时n(Y)=__________。
(3) 3 min末是否达到平衡_______(填是或否)。
(4)对于该反应,能增大正反应速率的措施是________(填序号,下同)。
A.缩小容器体积 B.移走部分Q
C.通入大量He气 D.升高温度
【题目】a、b、c、d是短周期元素,在周期表中的相对位置如图所示.d元素原子核外M层电子数是K层电子数的2倍.下列说法中,错误的是( )
a | b | c |
d |
A. 高温下,a单质可与d的氧化物发生置换反应
B. b的气态氢化物可与其最高价含氧酸反应
C. a、b、c 的最高正化合价等于其所在族序数
D. d的氧化物是制作光导纤维的材料