题目内容
(12分)短周期元素Q、R、T、P、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T的原子结构示意图为 ,用化学方程式表示工业上冶炼该单质的反应原理 。
(2)元素的非金属性:Q P(填“>”或“<”),可以证明该结论的实验是(用化学方程式表示) 。
(3)R的氢化物的结构式为 ,实验室检验该氢化物的方法是
_______________________________________________________________。
(4) W在周期表的位置为_________。W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体的化学式为 。利用该气体的
性,在海水提溴的过程中用该气体的水溶液吸收用空气吹出的溴蒸气。

(1)T的原子结构示意图为 ,用化学方程式表示工业上冶炼该单质的反应原理 。
(2)元素的非金属性:Q P(填“>”或“<”),可以证明该结论的实验是(用化学方程式表示) 。
(3)R的氢化物的结构式为 ,实验室检验该氢化物的方法是
_______________________________________________________________。
(4) W在周期表的位置为_________。W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体的化学式为 。利用该气体的
性,在海水提溴的过程中用该气体的水溶液吸收用空气吹出的溴蒸气。
(1) (1分) 2Al2O3(熔融)
(1分) 2Al2O3(熔融) 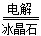 4Al+3O2↑(2分)。
4Al+3O2↑(2分)。
(2)>(1分),Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3(2分)。
(3)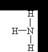 (1分),用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生(2分)
(1分),用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生(2分)
(4)第三周期第ⅥA族(1分)。SO2(1分),还原(1分)
 (1分) 2Al2O3(熔融)
(1分) 2Al2O3(熔融) 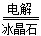 4Al+3O2↑(2分)。
4Al+3O2↑(2分)。(2)>(1分),Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3(2分)。
(3)
 (1分),用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生(2分)
(1分),用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生(2分)(4)第三周期第ⅥA族(1分)。SO2(1分),还原(1分)
 T所处的周期序数与主族序数相等,所以T是Al,则P是Si,Q是C,R是N,W是S。
T所处的周期序数与主族序数相等,所以T是Al,则P是Si,Q是C,R是N,W是S。(1)Al的原子序数是13,位于第三周期第ⅢA,原子结构示意图是 ;铝是活泼的金属,通过电解法冶炼,方程式为2Al2O3(熔融)
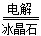 4Al+3O2↑。
4Al+3O2↑。 (2)同主族自上而下非金属性逐渐减弱,所以C的非金属性强于硅的;比较元素的非金属性,可以通过较强的酸制取较弱的酸来实现,即Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3。
(2)同主族自上而下非金属性逐渐减弱,所以C的非金属性强于硅的;比较元素的非金属性,可以通过较强的酸制取较弱的酸来实现,即Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3。(3)氨气是含有极性键的共价化合物,结构式为 ;氨气是一种碱性气体,据此可以鉴别,即用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生。
(4)S的原子序数是16,位于第三周期第ⅥA族;S和浓硫酸反应的生成物是SO2和水。SO2具有还原性,能被单质溴氧化。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
 ____。
____。
 后,得到气体的质量之比是____________________________。
后,得到气体的质量之比是____________________________。