题目内容
材料是当代社会发展的重要支柱之一.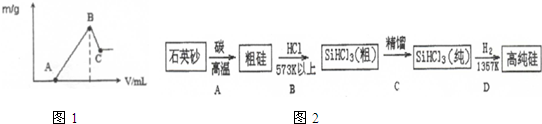
(1)镁铝合金是制造汽车、飞机外壳的重要金属材料.
①铝原子结构示意图为
②将镁铝合金投入氢氧化钠溶液中产生大量气泡,该反应的化学方程式为
③将2.52g镁、铝混合物溶于l00mL 2mol/L H2SO4溶液中,然后逐滴加入l mol/L NaOH溶液,其沉淀质量(m/g)随加入NaOH溶液的体积(V/mL)变化如图1所示.若A点时恰好消耗l60mL lmol/L NaOH溶液,则B点时溶液中的溶质是
(2)硅及其化合物是无机非金属材料的主角.
①制取光导纤维的主要原料是
②石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成
③工业上一种生产高纯硅过程示意图如图2:则在过程D中发生反应的化学方程式为
分析:(1)①铝原子核外有3个电子层,其最外层电子数是3;焊接镁铝合金时使用的保护气是稀有气体;
②铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
③根据图象知,硫酸有剩余,剩余n(H2SO4)=
n(NaOH)=
×1mol/L×0.16L=0.08mol,A、B段发生的反应为:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4、Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,B-C段发生的反应为NaOH+Al(OH)3=NaAlO2+2H2O;
(2)①制取光导纤维的主要原料是二氧化硅,制陶瓷的原料是粘土;
②石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成,书写顺序是:活泼金属元素氧化物、较活泼金属元素氧化物、二氧化硅、水;
③根据反应物、生成物和反应条件书写方程式.
②铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
③根据图象知,硫酸有剩余,剩余n(H2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
(2)①制取光导纤维的主要原料是二氧化硅,制陶瓷的原料是粘土;
②石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成,书写顺序是:活泼金属元素氧化物、较活泼金属元素氧化物、二氧化硅、水;
③根据反应物、生成物和反应条件书写方程式.
解答:解:(1)①铝原子核外有3个电子层,其最外层电子数是3,其原子结构示意图为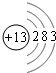 ;稀有气体不活泼,和一般的金属不反应,所以焊接镁铝合金时使用的保护气是稀有气体,故答案为:
;稀有气体不活泼,和一般的金属不反应,所以焊接镁铝合金时使用的保护气是稀有气体,故答案为: ;稀有气体;
;稀有气体;
②铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Na+2H2O+2NaOH=2NaAlO2+3H2↑,故答案为:2Na+2H2O+2NaOH=2NaAlO2+3H2↑;
③根据图象知,硫酸有剩余,剩余n(H2SO4)=
n(NaOH)=
×1mol/L×0.16L=0.08mol,与金属反应的n(H2SO4)=2mol/L×0.1L-0.08mol=0.12mol,
设镁的物质的量为x,铝的物质的量为y,
,所以n(Mg)=0.06mol、n(Al)=0.04mol,
A、B段发生的反应为:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4、Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,B-C段发生的反应为NaOH+Al(OH)3=NaAlO2+2H2O,所以B点的溶质是Na2SO4,C点固体是Mg(OH)2,根据镁原子守恒得m(Mg(OH)2)=n(Mg(OH)2).M(Mg(OH)2)=n(Mg).M(Mg(OH)2)=0.06mol×58g/mol=3.48g,
故答案为:Na2SO4;3.48g;
(2)①制取光导纤维的主要原料是SiO2,制陶瓷的原料是粘土,故答案为:SiO2;粘土;
②石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成,书写顺序是:活泼金属元素氧化物、较活泼金属元素氧化物、二氧化硅、水,所以为CaO.3MgO.4SiO2,故答案为:CaO.3MgO.4SiO2;
③根据反应物、生成物和反应条件知,该反应方程式为SiHCl3+H2
Si+3HCl,故答案为:SiHCl3+H2
Si+3HCl.
 ;稀有气体不活泼,和一般的金属不反应,所以焊接镁铝合金时使用的保护气是稀有气体,故答案为:
;稀有气体不活泼,和一般的金属不反应,所以焊接镁铝合金时使用的保护气是稀有气体,故答案为: ;稀有气体;
;稀有气体;②铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Na+2H2O+2NaOH=2NaAlO2+3H2↑,故答案为:2Na+2H2O+2NaOH=2NaAlO2+3H2↑;
③根据图象知,硫酸有剩余,剩余n(H2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
设镁的物质的量为x,铝的物质的量为y,
|
|
A、B段发生的反应为:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4、Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,B-C段发生的反应为NaOH+Al(OH)3=NaAlO2+2H2O,所以B点的溶质是Na2SO4,C点固体是Mg(OH)2,根据镁原子守恒得m(Mg(OH)2)=n(Mg(OH)2).M(Mg(OH)2)=n(Mg).M(Mg(OH)2)=0.06mol×58g/mol=3.48g,
故答案为:Na2SO4;3.48g;
(2)①制取光导纤维的主要原料是SiO2,制陶瓷的原料是粘土,故答案为:SiO2;粘土;
②石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成,书写顺序是:活泼金属元素氧化物、较活泼金属元素氧化物、二氧化硅、水,所以为CaO.3MgO.4SiO2,故答案为:CaO.3MgO.4SiO2;
③根据反应物、生成物和反应条件知,该反应方程式为SiHCl3+H2
| ||
| ||
点评:本题考查了镁铝化合物、硅的性质,根据反应物、生成物及反应条件书写方程式,难点是镁铝化合物的有关计算,明确图象中各段发生的反应是解本题关键,再结合原子守恒解答,题目难度中等.

练习册系列答案
相关题目
| |||||||||||