题目内容
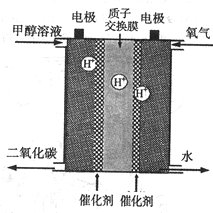
能源是人类社会发展进步的物质基础;在当代,能源同信息、材料一起构成了现代文明的三大支柱。(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。请写出表示甲醇燃烧的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.100 0 g工业甲醇样品,以适量H2SO4酸化后,加入20.00 mL 0.200 0 mol·L-1的K2Cr2O7溶液,过量的K2Cr2O7溶液,再用0.300 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00 mL时,刚好到达滴定终点。
已知:CH3OH+![]() +8H+
+8H+![]() CO2↑+2Cr3++6H2O
CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
(1)CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l);ΔH=-725.8 kJ·mol-1
CO2(g)+2H2O(l);ΔH=-725.8 kJ·mol-1
(2)①![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O ②96%
2Cr3++6Fe3++7H2O ②96%
解析:(1)1 mol甲醇完全燃烧生成H2O(l)放出的热量为
22.68 kJ×32=725.76 kJ
(2)①在酸性条件下![]() 将Fe2+氧化,
将Fe2+氧化,
![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
②根据关系式:
![]() — 6Fe2+
— 6Fe2+
1 6
n余=0.001 mol 0.3 mol·L-1×20×10-3 L=0.006 mol
CH3OH — ![]()
32 g 1 mol
m 0.2 mol·L-1×0.02 L-0.001 mol=0.003 mol
解得m=0.096 g
所以w(CH3OH)=![]() ×100%=96%
×100%=96%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| |||||||||||