题目内容
(12分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式
;
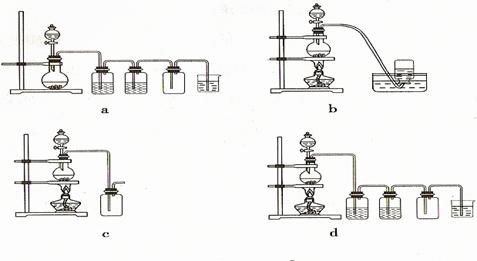
②试验装置用下列所有仪器连接而成,其中D、E可重复使用。按氢气流方向的连接顺序是(填入各仪器相应字母,如果认为必要可以补充):
A→( )→( )→( )→( )→( ) →F
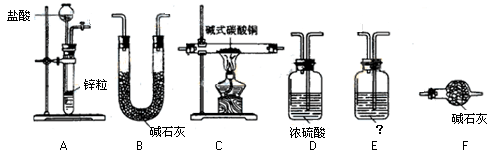
③E装置的作用是___________________,E中的药品最好是______________
A.水 B.饱和碳酸钠溶液 C.饱和碳酸氢钠溶液 D.氢氧化钠溶液
④称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?_______(填“可行”或“不可行”)如果可行写出反应的化学方程式:(认为不可行此空可不填) 。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式
;
②试验装置用下列所有仪器连接而成,其中D、E可重复使用。按氢气流方向的连接顺序是(填入各仪器相应字母,如果认为必要可以补充):
A→( )→( )→( )→( )→( ) →F

③E装置的作用是___________________,E中的药品最好是______________
A.水 B.饱和碳酸钠溶液 C.饱和碳酸氢钠溶液 D.氢氧化钠溶液
④称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?_______(填“可行”或“不可行”)如果可行写出反应的化学方程式:(认为不可行此空可不填) 。
(12分)
⑴① xCuCO3·yCu(OH)2·zH2O+(x+y)H 2 =" (x+y)Cu+" xCO2+(x+2y+z)H2O(2分)
 ② A EDCDB F(2分) ③A(1分) ④1.8 CuCO3·Cu(OH) 2·H2O(4分)
② A EDCDB F(2分) ③A(1分) ④1.8 CuCO3·Cu(OH) 2·H2O(4分)
⑵ 可行 xCuCO3·yCu(OH) 2·zH2O="(x+y)CuO+" xCO2↑+(y+z)H2O↑(3分)
可行 xCuCO3·yCu(OH) 2·zH2O="(x+y)CuO+" xCO2↑+(y+z)H2O↑(3分)
⑴① xCuCO3·yCu(OH)2·zH2O+(x+y)H 2 =" (x+y)Cu+" xCO2+(x+2y+z)H2O(2分)
 ② A EDCDB F(2分) ③A(1分) ④1.8 CuCO3·Cu(OH) 2·H2O(4分)
② A EDCDB F(2分) ③A(1分) ④1.8 CuCO3·Cu(OH) 2·H2O(4分)⑵
 可行 xCuCO3·yCu(OH) 2·zH2O="(x+y)CuO+" xCO2↑+(y+z)H2O↑(3分)
可行 xCuCO3·yCu(OH) 2·zH2O="(x+y)CuO+" xCO2↑+(y+z)H2O↑(3分)略

练习册系列答案
相关题目
 置序号
置序号
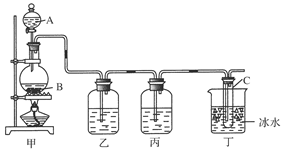
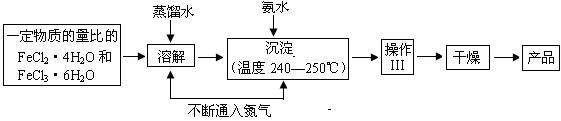
 入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
 滴定,至终点时消耗KMnO4溶液体积29.80mL。
滴定,至终点时消耗KMnO4溶液体积29.80mL。 实验目的的是( )
实验目的的是( )
 =3I2+3H2O+3K2SO4
=3I2+3H2O+3K2SO4