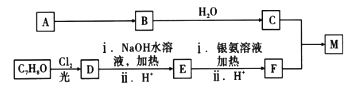
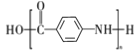
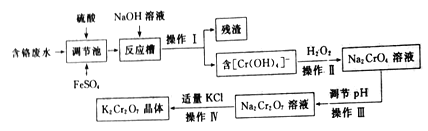
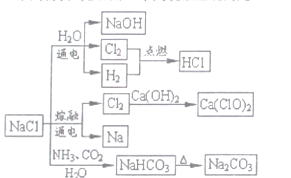
题目内容
【题目】某同学设计如下元素周期表,己知X元素的气态氢化物水溶液呈碱性,空格中均有对应的元素填充。以下说法正确的是
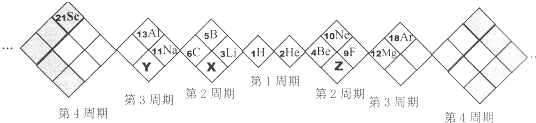
A. X、Y、Z元素分别为N、P、O
B. 白格中都是主族元素,灰格中都是副族元素
C. 原子半径:Z>X>Y
D. X、Y、Z的气态氢化物中最稳定的是:X的氢化物
【答案】A
【解析】A项,根据该同学设计的元素周期表的形式和位置可知:X的原子序数为7,Z的原子序数为8,Y的原子序数为15,因此X为N,Z为O,Y为P,故A正确;B项,白格中的稀有气体He、Ne、Ar不属于主族元素,故B错误;C项,同周期自左到右原子半径逐渐减小,原子半径N>O,同主族自上而下原子半径逐渐增大,原子半径P>N,因此原子半径P>N>O,故C错误;D项,非金属性:O>N>P,非金属性越强,气态氢化物越稳定,因此最稳定的是H2O,故D错误。

 名校课堂系列答案
名校课堂系列答案【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。