题目内容
19.在足量的水中加入0.2molAgNO3、0.1molBaCl2、0.1molNa2SO4,充分混合将所得溶液加入用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为( )| A. | 8:1 | B. | 1:8 | C. | 35.5:108 | D. | 108:35.5 |
分析 将以上3种盐溶于水后,若相互不反应,溶液中有0.2mol银离子、0.2mol氯离子、0.1mol钡离子、0.1mol硫酸根离子、0.2mol硝酸根离子、0.2mol钠离子,其中0.2mol银离子和0.2mol氯离子恰好形成AgCl沉淀,0.1mol钡离子和0.1mol硫酸根离子恰好形成BaSO4沉淀,剩余溶液为NaNO3溶液,据此分析.
解答 解:将以上3种盐溶于水后,若相互不反应,溶液中有0.2mol银离子、0.2mol氯离子、0.1mol钡离子、0.1mol硫酸根离子、0.2mol硝酸根离子、0.2mol钠离子,其中0.2mol银离子和0.2mol氯离子恰好形成AgCl沉淀,0.1mol钡离子和0.1mol硫酸根离子恰好形成BaSO4沉淀,溶液为NaNO3溶液,电解NaNO3溶液时,
阳极发生氧化反应,得到氧化产物,阳极电极反应式为:4OH--4e-=2H2O+O2↑
阴极发生还原反应,得到还原产物,阴极电极反应式为:4H++4e-=2H2↑,
据阴阳两极得失电子相等,氧化产物和还原产物的物质的量之比为1:2,质量比为32:4=8:1,
故选:A.
点评 本题考查电解知识,题目难度中等,解答本题的关键是根据混合物的性质判断反应后滤液的成分,注意仔细审题.

练习册系列答案
相关题目
9.下列关于金属钠的叙述中,正确的是( )
| A. | 钠暗灰色固体 | |
| B. | 将金属钠在空气中加热则生成白色固体 | |
| C. | 钠投入到Fe2(SO4)3溶液中,钠先与H2O反应,钠投入到稀H2SO4中,钠也是先与H2O反应 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |
10.下列关于原子的描述中,不正确的是( )
| A. | 汤姆生发现原子中存在电子 | |
| B. | 某金属元素原子失去电子时只能形成一种阳离子 | |
| C. | 原子是化学变化中的最小微粒 | |
| D. | 每个质子和中子的相对质量都约为1 |
7.${\;}_{\;}^{32}$S与${\;}_{\;}^{33}$S互为同位素,二者不相同的( )
| A. | 质量数 | B. | 电子层数 | C. | 电子数 | D. | 质子数 |
14.根据如图判断下列说法正确的是( )
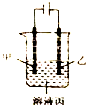

| A. | 若模拟铜的精炼原理,则乙为粗制 | |
| B. | 若模拟电镀原理,则甲为镀层金属 | |
| C. | 若模拟外加电流的阴极保护法防止金属腐蚀,则甲为被保护的金属 | |
| D. | 若甲、乙均为石墨,丙为稀硫酸,则通电一段时间后,硫酸的物质的两浓度减小 |
11.锂和钠两种元素相比较,正确的是( )
| A. | 锂的还原性比钠的弱 | B. | 锂原子的半径比钠的大 | ||
| C. | 锂的金属性比钠的强 | D. | 锂单质的熔点比钠的低 |
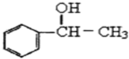
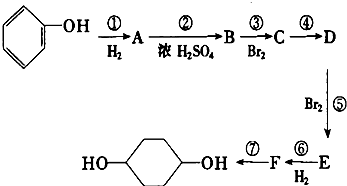
8.对1mol的己烯雌酚在如图变化中的有关预测正确的是( )
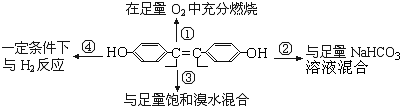

| A. | ①中生成7molH2O | B. | ②中生成2molCO2 | ||
| C. | ③中最多消耗3molBr2 | D. | ④中最多消耗7molH2 |
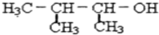
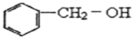
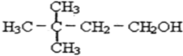
 、D
、D .
.
 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ .
.