题目内容
(9分)(1)电动汽车的动力系统由“10kW电机+144V镍氢电池”组成。
镍氢电池的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2="==" NiO(OH)+1/2H2。其放电时正极电极反应式为_________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
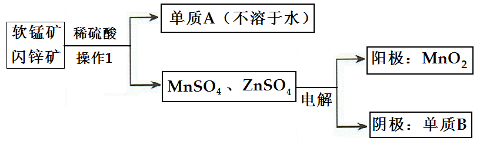
①单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:________________
镍氢电池的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH)作为电解液,镍氢电池充电时发生反应:Ni(OH)2="==" NiO(OH)+1/2H2。其放电时正极电极反应式为_________________________________。
(2)二氧化锰、锌是制造干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:

①单质A为____________,单质B为______________。
②上述电解过程中,当阴极生成6.5gB时阳极生成MnO2质量为_________________。
③利用铝热反应原理,可从软锰矿中提取单质锰,写出其化学反应式:________________
(9分)
(l)NiO(OH)+ H2O+e===Ni(OH)2+OH-(2分)
⑵①S Zn (各2分)②8.7g(1分)③ (2分)
(2分)
(l)NiO(OH)+ H2O+e===Ni(OH)2+OH-(2分)
⑵①S Zn (各2分)②8.7g(1分)③
 (2分)
(2分)(1)镍氢电池放电时,负极:H2-2e-+2OH-=H2O 正极:NiO(OH)+ H2O+e===Ni(OH)2+OH-
(2)①经过操作I可知单质A为硫单质;电解后,阳极生成MnO2,阴极产生了锌。
②由电子守恒知道:MnO2~2e-~Zn,可求出,当阴极生成6.5gZn时阳极生成MnO2质量为8.7g
③铝与氧化物在高温下的置换反应
(2)①经过操作I可知单质A为硫单质;电解后,阳极生成MnO2,阴极产生了锌。
②由电子守恒知道:MnO2~2e-~Zn,可求出,当阴极生成6.5gZn时阳极生成MnO2质量为8.7g
③铝与氧化物在高温下的置换反应

练习册系列答案
相关题目
 Cd(OH)2(s) + 2 Ni(OH)2(s)
Cd(OH)2(s) + 2 Ni(OH)2(s)

 2PbSO4+2H2O
2PbSO4+2H2O