题目内容
16.在2FeS+6H2SO4(浓)═Fe2(SO4)3+3SO2↑+2S↓+6H2O的反应中:(1)被氧化的元素为硫、铁(填元素名称); 氧化产物是Fe2(SO4)3、S,还原产物是SO2.
(2)当有32克S生成时,消耗氧化剂的质量为147克.
分析 (1)在氧化还原反应中,失电子的反应物是还原剂,得电子的反应物是氧化剂,还原剂在反应中被氧化,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
(2)根据方程式2FeS+6H2SO4(浓)═Fe2(SO4)3+3SO2↑+2S↓+6H2O,有2molS生成,则消耗氧化剂浓硫酸为3mol,据此计算.
解答 解:(1)该反应中,铁元素的化合价由+2价→+3价,失电子被氧化,硫元素的化合价由-2价→0价和+6→+4价,所以部分硫元素被氧化,部分被还原,所以H2SO4是氧化剂,SO2是还原产物,硫化亚铁是还原剂,Fe2(SO4)3、S是氧化产物,故答案为:硫、铁;Fe2(SO4)3、S;SO2;
(2)根据方程式2FeS+6H2SO4(浓)═Fe2(SO4)3+3SO2↑+2S↓+6H2O,有2molS生成,则消耗氧化剂浓硫酸为3mol,所以有32克S生成时即1mol,则消耗氧化剂H2SO4是1.5mol,质量为1.5×98=147g,故答案为:147.
点评 本题考查氧化还原反应,明确元素化合价是解本题的关键,注意该题中浓硫酸部分是氧化剂,难度不大.

练习册系列答案
相关题目
6.下列化合物的1H-NMR谱图中吸收峰数目正确的是( )
| A. | CH3CH2CH2CH3(3组) | B. | CH2═CH-CH2CH3(2组) | ||
| C. | 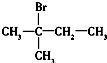 (4组) (4组) | D. | 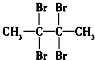 (1组) (1组) |
4.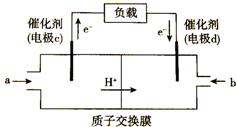 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
电解一段时间后,两极收集到相同体积(相同条件)的气体,(忽略溶液体积的变化及电极产物可能存在的溶解现象)则整个电解过程中阳极发生反应的电极反应式为2Cl --2e-=Cl2↑,4OH--4e-=2H2O+O2↑.
 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
11.下列溶液中c(Cl-)与50mL 1mol/L AlCl3溶液中c(Cl-)相等的是( )
| A. | 150mL 1mol/L的NaCl溶液 | B. | 75mL 1mol/L的FeCl3溶液 | ||
| C. | 150mL 0.5mol/L的MgCl2溶液 | D. | 75mL 2mol/L的NH4Cl溶液 |
1.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO.其过程如:mCeO2$→_{①}^{太阳能}$(m-x)CeO2•xCe+xO2,(m-x)CeO2•xCe+xH2O+xCO2$→_{②}^{900℃}$mCeO2+xH2+xCO.下列说法不正确的是( )
| A. | 该过程中CeO2需要不断补充 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 二氧化铈(CeO2)是该反应的催化剂 | |
| D. | 该反应的副产物是O2 |
6.下列变化:①液态水汽化②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解⑤生石灰跟水反应;属于吸热反应的是( )
| A. | ②④ | B. | ①④ | C. | ②③ | D. | ①④⑤ |
 .
.