题目内容
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L1 | 溶液的密度/g·cm3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、 ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为 mol·L1。
(3)将物质的量浓度分别为c2 mol·L1和![]() c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度
c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度 ![]() c2 mol·L1(设混合后溶液的体积变化忽略不计)。
c2 mol·L1(设混合后溶液的体积变化忽略不计)。
【答案】(1)![]() %
%
(2)c1 /2
(3)大于 大于
【解析】(1)设硫酸的体积为1 L,则w(H2SO4)= ![]() ×100%=
×100%=![]() %。
%。
(2)硫酸与水等体积混合(混合后溶液的体积变化忽略不计),溶液的体积变为原来的2倍,则浓度为c1/2
mol·L1。
(3)根据图像可知,氨水的浓度越大,密度越小,则c2 mol·L1氨水的密度小于![]() c2 mol·L1氨水的密度,等质量时,
c2 mol·L1氨水的密度,等质量时,![]() c2 mol·L1氨水的体积小于c2 mol·L1氨水的体积。两者混合后,所得溶液的密度一定比ρ2大,所得溶液的物质的量浓度趋近于体积大者,故大于
c2 mol·L1氨水的体积小于c2 mol·L1氨水的体积。两者混合后,所得溶液的密度一定比ρ2大,所得溶液的物质的量浓度趋近于体积大者,故大于![]() c2 mol·L1。
c2 mol·L1。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42-的离子个数比为
A. 1:2 B. 1:4 C. 3:4 D. 3:2
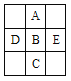
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
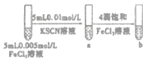
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
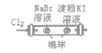
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D