题目内容
10.化学物质丰富多彩,其与生产、生活密切相关.下列物质的用途不正确的是( )| A. | 食醋可用于除去暖水瓶中的水垢 | B. | 单质硅可用作光缆 | ||
| C. | 酒精可用于杀菌消毒 | D. | 纯碱可除去灶具上的油污 |
分析 A.水垢成分为碳酸钙、氢氧化镁,二者都能与食醋反应;
B.二氧化硅作光缆;
C.酒精使蛋白质变性;
D.灶具上的油污为油脂,油脂碱性环境下能够水解.
解答 解:A.水垢成分为碳酸钙、氢氧化镁,二者都能与醋酸反应,所以可以用食醋除去暖水瓶中的水垢,故A正确;
B.硅是半导体材料,能导电,二氧化硅能传递光信号,可用作光缆,故B错误;
C.酒精能够使蛋白质变性,可以用于杀菌消毒,故C正确;
D.纯碱水解显碱性,油脂碱性环境下能够水解,所以纯碱可除去灶具上的油污,故D正确;
故选B.
点评 本题考查物质的性质与用途,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活、生产的联系,题目难度不大.

练习册系列答案
相关题目
5.化学与环境、材料、信息、生活等关系密切,下列说法错误的是( )
| A. | 利用生物质能就是间接利用太阳能 | |
| B. | 地沟油经过加工处理后可用来制生物柴油和肥皂 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | “光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关 |
15. 某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.
某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.
(1)向20mL 0.01mol/L的FeCl3溶液中滴入20滴0.03mol/L的KSCN溶液,相关化学方程式为FeCl3+3KSCN?Fe(SCN)3+3KCl;可观察到的实验现象是浅黄色溶液变成红色.
(2)下列能说明(1)中反应达到平衡的是AC(填序号).
A.溶液颜色不再发生变化 B.反应不再发生
C.Fe3+浓度不再变化 D.K+浓度不再发生变化
E.反应物和产物浓度相等
(3)将上述(1)所得溶液平均分成四份进行下列实验,试完成表格方案.
(4)上述实验中研究反应物浓度减小对平衡移动影响的是②③(填编号);实验③加5mL水的目的是对比实验,消除加入的氢氧化钠溶液导致的溶液稀释对各离子浓度的影响;在实验①中,若tl时刻代表加入试剂的时间,请完成c(Fe3+)~t图象:
(5)根据上述研究,小组提出用比色法测量FeCl3溶液的浓度.
I.比色板的制作
步骤一:(不必回答具体操作);
步骤二:分别取2mL上述FeCl3系列溶液于不同试管中,分别加入5滴0.03mol/L的KSCN溶液,振荡摇匀,在试管上标注相应反应物的浓度并将试管按照颜色由浅到深的顺序排列(比色板).
II.溶液浓度的测定
取5 mL待测FeCl3溶液于试管中,加入5滴0.03mol/L的KSCN溶液.将所得溶液与步骤二的比色板对比,读取待测FeCl3溶液浓度.
 某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.
某学习小组拟研究化学平衡建立以及浓度对化学平衡移动的影响.(1)向20mL 0.01mol/L的FeCl3溶液中滴入20滴0.03mol/L的KSCN溶液,相关化学方程式为FeCl3+3KSCN?Fe(SCN)3+3KCl;可观察到的实验现象是浅黄色溶液变成红色.
(2)下列能说明(1)中反应达到平衡的是AC(填序号).
A.溶液颜色不再发生变化 B.反应不再发生
C.Fe3+浓度不再变化 D.K+浓度不再发生变化
E.反应物和产物浓度相等
(3)将上述(1)所得溶液平均分成四份进行下列实验,试完成表格方案.
| 实验编号 | ① | ② | ③ | |
| 加入试剂 | 5mL 6mol/L FeCl3溶液和5滴0.03mol/L 的KSCN溶液 | 少量铁粉 | 5mL水 | 5mL NaOH溶液 |
| 现象预期 | 红色加深 | 溶液红色变浅 | 加入5mL NaOH溶液后,溶液颜色较加5mL水后更浅(填“更深”“更浅”或“相同”) | |
(5)根据上述研究,小组提出用比色法测量FeCl3溶液的浓度.
I.比色板的制作
步骤一:(不必回答具体操作);
步骤二:分别取2mL上述FeCl3系列溶液于不同试管中,分别加入5滴0.03mol/L的KSCN溶液,振荡摇匀,在试管上标注相应反应物的浓度并将试管按照颜色由浅到深的顺序排列(比色板).
II.溶液浓度的测定
取5 mL待测FeCl3溶液于试管中,加入5滴0.03mol/L的KSCN溶液.将所得溶液与步骤二的比色板对比,读取待测FeCl3溶液浓度.
2.化学与生产、生活密切相关. 下列说法不正确的是( )
| A. | 福尔马林可浸制标本,因其可使蛋白质变性的性质 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应 | |
| C. | 将地沟油制成肥皂,可以提高资源的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
19.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | Fe(OH)3沉淀被氢碘酸溶解:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Ca(HCO3)2溶液中加入少量NaOH:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用铜电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
10.某K2SO4和Al2(SO4)3的混合溶液,已知C(Al3+)=0.2mol/L,C(SO42-)=0.6mol/L,则K+的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.4mol/L | D. | 0.6mol/L |

 ;
; .
.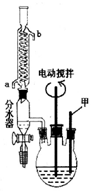 苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:
苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下: