题目内容
18.下列叙述不正确的是( )| A. | 根据能量守定律可知,反应物的总能量等于生成物的总能量 | |
| B. | 化学能可以转化为热能、电能、光能等 | |
| C. | 氢氧化钡晶体与氯化铵固体反应是吸热的 | |
| D. | 酸碱中和反应是放热的 |
分析 A.化学反应一定有能量的变化;
B.不能的能量可以相互转化可以相互转化;
C.常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数分解、置换以及某些复分解反应(如铵盐和强碱);
D.常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应.
解答 解:A.化学反应中反应物的能量与生成物的能量一定不同,故A错误;
B.化学能与光能、电能、热能等可以相互转化,故B正确;
C.氢氧化钡与氯化铵反应吸热,故C正确;
D.酸碱中和反应是放热反应,故D正确;
故选A.
点评 本题主要考查化学反应中能量转化形式,以及常见的吸热反应和放热反应,题目难度不大.

练习册系列答案
相关题目
8.下列溶液中,能大量共存的离子组是( )
| A. | Ba2+、Cu2+、C1-、NO3- | B. | Ca2+、Al3+、Br-、ClO- | ||
| C. | NH4+、K+、HSO3-、CO32- | D. | Na+、K+、MnO4-、I- |
9.下列关于氧化还原反应的叙述中,正确的是( )
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 一种物质被氧化,必有另一种物质被还原 | |
| C. | 2Fe+3Cl2═2FeCl3; Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS 由此可以判断氧化性:Cl2>S | |
| D. | Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg |
6.能说明苯分子的平面正六边形的结构中,碳碳键不是单、双键交替的事实是( )
| A. | 溴苯没有同分异构体 | B. | 苯能与氢气加成得到环己烷 | ||
| C. | 间二甲苯只有一种 | D. | 邻二甲苯只有一种结构 |
3.等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论中,不正确的是( )
| A. | 瓶中气体的黄绿色变浅 | |
| B. | 瓶内壁有油状液滴生成 | |
| C. | 生成物只有CH3Cl和HCl | |
| D. | 此反应的生成物可能是CH3Cl、CH2Cl2、CHCl3、CCl4和HCl的混合物 |
10.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物 | |
| B. | 乙烷(乙烯):通过盛有足量酸性KMnO4溶液的洗气瓶洗气 | |
| C. | CCl4(乙醇):多次加水,振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
7.下列离子方程式,正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
8.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molCl2与一定量的Fe刚好完全反应电子转移数为3NA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 在 H2O2+Cl2═2HCl+O2反应中,每生成NA个O2分子,消耗的Cl2的体积是22.4L | |
| D. | 将10mL5mol•L-1的FeCl3溶液滴入沸水中得到Fe(OH)3胶体,其胶粒数为0.05NA |
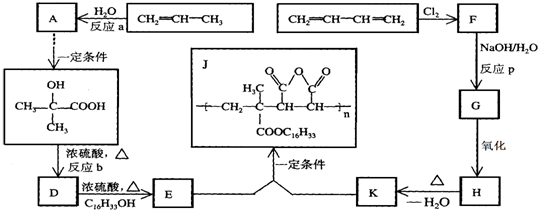
 +H2O
+H2O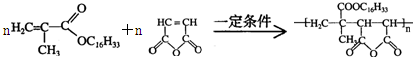 ;
;