题目内容
【题目】二甲醚(CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是

A. 该装置能实现化学能100%转化为电能
B. 电子移动方向为:a极→b极→质子交换膜→a极
C. a电极的电极反应式为:CH3OCH3+3H2O=2CO2+12e-+12H+
D. 当b电极消耗22.4LO2时,质子交換膜有4moIH+通过
【答案】C
【解析】燃料电池中通入燃料的一极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极反应式为:CH3OCH3+3H2O-12e-═2CO2+12H+,通入氧气的一极为正极,即B电极为正极;溶液中阳离子向正极移动,即H+从A移向B;
A、能量的转化率很难达到100%,该装置不能实现化学能100%转化为电能,故A错误;B、电子不在溶液中移动,故B错误;C、燃料电池中通入燃料的一极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极反应式为:CH3OCH3+3H2O-12e-═2CO2+12H+,故C正确;D、当b电极消耗22.4LO2时,没有强调气体为标准状况,故D错误;故选C。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
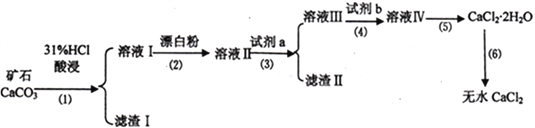
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。