题目内容
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )
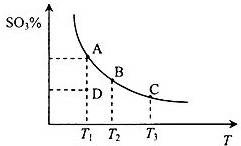
| A.在D点时v正<v逆 |
| B.反应2SO2(g)+O2(g)?2SO3(g)的△H<0 |
| C.若B、C点的平衡常数分别为KB、KC,则KB>KC |
| D.恒温恒压下向平衡体系中通入氦气,平衡向左移动 |

A、曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应向正反应移动,故v正>v逆,故A错误;
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动,故该反应正反应是放热反应,故B正确;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小,B点的温度低于C的温度,故平衡常数,KB>KC,故C正确;
D、恒温恒压下向平衡体系中通入氦气,体积增大,参与反应气体压强降低,平衡向体积增大的方向移动,即向平衡向左移动,故D正确.
故选A.
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动,故该反应正反应是放热反应,故B正确;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小,B点的温度低于C的温度,故平衡常数,KB>KC,故C正确;
D、恒温恒压下向平衡体系中通入氦气,体积增大,参与反应气体压强降低,平衡向体积增大的方向移动,即向平衡向左移动,故D正确.
故选A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示: